作成又は改訂年月
**
2020年2月改訂
(第9版)
*
2018年7月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
パシーフカプセル30mg
販売名コード
承認・許可番号
21700AMZ00737
PACIF capsules 30mg.
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱に表示の使用期限内に使用すること。
(使用期限内であっても開封後はなるべく速やかに使用すること。)
規制区分
劇薬
麻薬
処方箋医薬品注1)
注1)処方箋医薬品:注意−医師等の処方箋により使用すること
組成
1カプセル中の有効成分
モルヒネ塩酸塩水和物 30mg
添加物
結晶セルロース、トウモロコシデンプン、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルセルロース、ポビドンK30、マクロゴール6000、酒石酸、ヒプロメロース、タルク、エチルセルロース、カルボキシビニルポリマー、セタノール
性状
| 色調・剤形 | 白色〜帯黄白色の粒を含む淡黄色のカプセル剤 |
|---|
| 識別コード | 851 |
|---|
| 形状 |  |
|---|
| 号数 | 5号 |
|---|
| 長径(mm) | 11.1 |
|---|
| 短径(mm) | 4.7 |
|---|
販売名
パシーフカプセル60mg
販売名コード
承認・許可番号
21700AMZ00738
PACIF capsules 60mg.
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱に表示の使用期限内に使用すること。
(使用期限内であっても開封後はなるべく速やかに使用すること。)
規制区分
劇薬
麻薬
処方箋医薬品注1)
注1)処方箋医薬品:注意−医師等の処方箋により使用すること
組成
1カプセル中の有効成分
モルヒネ塩酸塩水和物 60mg
添加物
結晶セルロース、トウモロコシデンプン、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルセルロース、ポビドンK30、マクロゴール6000、酒石酸、ヒプロメロース、タルク、エチルセルロース、カルボキシビニルポリマー、セタノール
性状
| 色調・剤形 | 白色〜帯黄白色の粒を含む淡黄色のカプセル剤 |
|---|
| 識別コード | 852 |
|---|
| 形状 |  |
|---|
| 号数 | 4号 |
|---|
| 長径(mm) | 14.0 |
|---|
| 短径(mm) | 5.0 |
|---|
販売名
パシーフカプセル120mg
販売名コード
承認・許可番号
21700AMZ00739
PACIF capsules 120mg.
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱に表示の使用期限内に使用すること。
(使用期限内であっても開封後はなるべく速やかに使用すること。)
規制区分
劇薬
麻薬
処方箋医薬品注1)
注1)処方箋医薬品:注意−医師等の処方箋により使用すること
組成
1カプセル中の有効成分
モルヒネ塩酸塩水和物 120mg
添加物
結晶セルロース、トウモロコシデンプン、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルセルロース、ポビドンK30、マクロゴール6000、酒石酸、ヒプロメロース、タルク、エチルセルロース、カルボキシビニルポリマー、セタノール
性状
| 色調・剤形 | 白色〜帯黄白色の粒を含む淡黄色のカプセル剤 |
|---|
| 識別コード | 853 |
|---|
| 形状 |  |
|---|
| 号数 | 2号 |
|---|
| 長径(mm) | 17.4 |
|---|
| 短径(mm) | 6.0 |
|---|
一般的名称
禁忌
重篤な呼吸抑制のある患者[呼吸抑制を増強する。]
気管支喘息発作中の患者[気道分泌を妨げる。]
重篤な肝障害のある患者[昏睡に陥ることがある。]
慢性肺疾患に続発する心不全の患者[呼吸抑制や循環不全を増強する。]
痙攣状態(てんかん重積症、破傷風、ストリキニーネ中毒)にある患者[脊髄の刺激効果があらわれる。]
急性アルコール中毒の患者[呼吸抑制を増強する。]
アヘンアルカロイドに対し過敏症の患者
出血性大腸炎の患者[腸管出血性大腸菌(O157等)や赤痢菌等の重篤な細菌性下痢のある患者では、症状の悪化、治療期間の延長をきたすおそれがある。]
**ナルメフェン塩酸塩水和物を投与中又は投与中止後1週間以内の患者(「相互作用」の項参照)
原則禁忌
細菌性下痢のある患者[治療期間の延長をきたすおそれがある。]
効能又は効果
効能又は効果に関連する使用上の注意
本剤は持続性癌疼痛治療剤であり、疼痛増強時や突発性の疼痛が発現した場合の追加投与(レスキュードーズ)には使用しないこと。
用法及び用量
通常、成人にはモルヒネ塩酸塩水和物として1日30〜120mgを1日1回経口投与する。なお、年齢、症状により適宜増減する。
用法及び用量に関連する使用上の注意
初回投与
本剤の投与開始前のオピオイド系鎮痛薬による治療の有無を考慮して初回投与量を設定することとし、すでに治療されている場合にはその投与量及び鎮痛効果の持続を考慮して副作用の発現に注意しながら適宜投与量を調節すること。
モルヒネ硫酸塩徐放剤から本剤へ変更する場合
モルヒネ硫酸塩徐放剤の1日投与量と同量を、本剤の1日投与量の目安とすること。
オキシコドン塩酸塩徐放剤から本剤へ変更する場合
オキシコドン塩酸塩徐放剤1日投与量の1.5倍量を、本剤の1日投与量の目安とすること。
経皮フェンタニル貼付剤から本剤へ変更する場合
経皮フェンタニル貼付剤剥離後にフェンタニルの血中濃度が50%に減少するまで17時間以上かかることから、剥離直後の本剤の使用は避け、本剤の使用を開始するまでに、フェンタニルの血中濃度が適切な濃度に低下するまでの時間をあけるとともに、本剤の低用量から投与することを考慮すること。
疼痛増強時
本剤服用中に疼痛が増強した場合や鎮痛効果が得られている患者で突発性の疼痛が発現した場合は、直ちにモルヒネ速溶性製剤の追加投与(レスキュードーズ:1日投与量の6分の1量を目安とする)を行い鎮痛を図ること。
増量
本剤投与開始後は患者の状態を観察し、適切な鎮痛効果が得られ副作用が最小となるよう用量調節を行うこととし、増量する場合は1日あたり30mg増あるいは30〜50%増とする。
減量
連用中における急激な減量は、退薬症候があらわれることがあるので行わないこと。副作用等により減量する場合は、患者の状態を観察しながら慎重に行うこと。
投与の中止
本剤の投与を必要としなくなった場合には、退薬症候の発現を防ぐために徐々に減量すること。
使用上の注意
慎重投与
心機能障害のある患者[循環不全を増強するおそれがある。]
呼吸機能障害のある患者[呼吸抑制を増強するおそれがある。]
肝・腎機能障害のある患者[代謝・排泄が遅延し副作用があらわれるおそれがある。]
脳に器質的障害のある患者[呼吸抑制や頭蓋内圧の上昇を起こすおそれがある。]
ショック状態にある患者[循環不全や呼吸抑制を増強するおそれがある。]
代謝性アシドーシスのある患者[呼吸抑制を起こすおそれがある。]
甲状腺機能低下症(粘液水腫等)の患者[呼吸抑制や昏睡を起こすおそれがある。]
副腎皮質機能低下症(アジソン病等)の患者[呼吸抑制作用に対し、感受性が高くなっている。]
薬物依存の既往歴のある患者[依存性を生じやすい。]
高齢者(「高齢者への投与」の項参照)
新生児、乳児(「小児等への投与」の項参照)
衰弱者[呼吸抑制作用に対し、感受性が高くなっている。]
前立腺肥大による排尿障害、尿道狭窄、尿路手術術後の患者[排尿障害を増強することがある。]
器質的幽門狭窄、麻痺性イレウス又は最近消化管手術を行った患者[消化管運動を抑制する。]
痙攣の既往歴のある患者[痙攣を誘発するおそれがある。]
胆嚢障害及び胆石のある患者[胆道痙攣を起こすことがある。]
重篤な炎症性腸疾患のある患者[連用した場合、巨大結腸症を起こすおそれがある。]
ジドブジン(アジドチミジン)を投与中の患者(「相互作用」の項参照)
重要な基本的注意
本剤は徐放性製剤であることから、急激な血中濃度の上昇により重篤な副作用の発現を避けるため、服用に際してカプセルの内容物を砕いたり、すりつぶしたりしないで、そのままかまずに服用するよう指示すること。(「適用上の注意」の項参照)
連用により薬物依存を生じることがあるので、観察を十分に行い、慎重に投与すること。(「重大な副作用」の項参照)
眠気、眩暈が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
本剤を投与する場合には、便秘に対する対策として緩下剤、嘔気・嘔吐に対する対策として制吐剤の併用を、また、鎮痛効果が得られている患者で通常とは異なる強い眠気がある場合には、過量投与の可能性を念頭において本剤の減量を考慮するなど、本剤投与時の副作用に十分注意すること。
本剤を増量する場合には、副作用に十分注意すること。
本剤の医療目的外使用を防止するため、適切な処方を行い、保管に留意するとともに、患者等に対して適切な指導を行うこと。(「適用上の注意」の項参照)
相互作用
併用禁忌
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
| **ナルメフェン塩酸塩水和物 セリンクロ | **本剤の離脱症状があらわれるおそれがある。また、本剤の効果が減弱するおそれがある。μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 | |
|---|
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
中枢神経抑制剤 フェノチアジン系薬剤、バルビツール酸系薬剤 等
吸入麻酔剤
モノアミン酸化酵素阻害剤
三環系抗うつ剤
β−遮断剤
アルコール | 相加的抑制作用により、呼吸抑制、低血圧及び顕著な鎮静又は昏睡が起こることがある。 |
|---|
| クマリン系抗凝血剤 | クマリン系抗凝血剤の作用が増強することがある。 |
|---|
| 抗コリン作動性薬剤 | 麻痺性イレウスに至る重篤な便秘又は尿貯留が起こるおそれがある。モルヒネには腸管神経叢でのアセチルコリン遊離抑制作用、尿路平滑筋収縮作用があり、抗コリン作動性薬剤には消化管緊張、自動運動の抑制作用並びに膀胱括約筋を収縮させる傾向がある。 |
|---|
| ジドブジン(アジドチミジン) | 肝臓でのグルクロン酸抱合における競合的阻害により、ジドブジンのクリアランスを低下させる。 |
|---|
| ブプレノルフィン | ブプレノルフィンの高用量(8mg連続皮下投与)において、本剤の作用に拮抗するとの報告がある。オピオイド受容体に対する競合的阻害による。 | |
|---|
副作用
副作用等発現状況の概要
承認時までの臨床試験では201例中101例(50.2%)に臨床検査値の異常を含む副作用が認められている。
重大な副作用
連用により薬物依存(頻度不明※)を生じることがあるので、観察を十分に行い、慎重に投与すること。また、連用中における投与量の急激な減少ないし投与の中止により、あくび、くしゃみ、流涙、発汗、悪心、嘔吐、下痢、腹痛、散瞳、頭痛、不眠、不安、せん妄、振戦、全身の筋肉・関節痛、呼吸促迫等の退薬症候があらわれることがあるので、投与を中止する場合には、1日用量を徐々に減量するなど、患者の状態を観察しながら行うこと。
呼吸抑制(頻度不明※)があらわれることがあるので、息切れ、呼吸緩慢、不規則な呼吸、呼吸異常等があらわれた場合には、投与を中止するなど適切な処置を行うこと。なお、本剤による呼吸抑制には、麻薬拮抗剤(ナロキソン、レバロルファン等)が拮抗する。
錯乱、せん妄(いずれも頻度不明※)があらわれることがあるので、このような場合には、減量又は投与を中止するなど適切な処置を行うこと。
無気肺、気管支痙攣、喉頭浮腫(いずれも頻度不明※)があらわれるとの報告がある。
臨床試験においてイレウス(1%)、腸管麻痺(0.5%)が報告されている。また、炎症性腸疾患の患者に投与した場合、中毒性巨大結腸(頻度不明※)があらわれるとの報告がある。
※)本剤の承認時までの臨床試験では認められなかったが、モルヒネ製剤でみられている副作用。
その他の副作用
過敏症注2)
1〜5%未満
そう痒
過敏症注2)
頻度不明※
発疹
精神神経系
5%以上
眠気
精神神経系
1〜5%未満
頭痛、めまい
精神神経系
頻度不明※
不安、不穏、興奮、視調節障害、発汗
消化器
5%以上
嘔気、嘔吐、便秘
消化器
1〜5%未満
食欲不振、下痢、口渇
循環器
頻度不明※
不整脈、血圧変動、顔面潮紅
肝臓
1〜5%未満
AST(GOT)、AL-P、LDH、ビリルビンの上昇
血液
1〜5%未満
貧血、白血球増多、好中球増多、リンパ球減少、血小板減少、血小板増多
その他
1〜5%未満
排尿障害、倦怠感、発熱、BUN、クレアチニンの上昇
その他
頻度不明※
頭蓋内圧の亢進
その他の副作用の注意
注2)このような場合には投与を中止すること。
※)本剤の承認時までの臨床試験では認められなかったが、モルヒネ製剤でみられている副作用。
高齢者への投与
高齢者では低用量から投与を開始するなど患者の状態を観察しながら、慎重に投与すること。[一般に高齢者では生理機能が低下しており、特に呼吸抑制の感受性が高い。]
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。[動物試験(マウス、ラット)で催奇形作用が報告されている。]
分娩前に投与した場合、出産後新生児に退薬症候(多動、神経過敏、不眠、振戦等)があらわれることがある。
分娩時の投与により、新生児に呼吸抑制があらわれることがある。
授乳中の婦人には、本剤投与中は授乳を避けさせること。[ヒト母乳中へ移行することがある。]
小児等への投与
小児等に対する安全性は確立していない(使用経験がない)。なお、新生児、乳児には、低用量から投与を開始するなど患者の状態を観察しながら、慎重に投与すること。[呼吸抑制の感受性が高い。]
過量投与
徴候・症状
呼吸抑制、意識不明、痙攣、錯乱、血圧低下、重篤な脱力感、重篤なめまい、嗜眠、心拍数の減少、神経過敏、不安、縮瞳、皮膚冷感等を起こすことがある。
処置
過量投与時には以下の治療を行うことが望ましい。
投与を中止し、気道確保、補助呼吸及び呼吸調節により適切な呼吸管理を行う。
麻薬拮抗剤投与を行い、患者に退薬症候又は麻薬拮抗剤の副作用が発現しないよう慎重に投与する。なお、麻薬拮抗剤の作用持続時間はモルヒネのそれより短いので、患者のモニタリングを行うか又は患者の反応に応じて初回投与後は注入速度を調節しながら持続静注する。
必要に応じて補液、昇圧剤等の投与又は他の補助療法を行う。
適用上の注意
本剤は持続性製剤であることから、早期に除痛を必要とする場合は、速溶性製剤を用いることが望ましい。
患者等に対する指導:
本剤は徐放性製剤であるため、カプセルの内容物を砕いたり、すりつぶしたりしないで、そのままかまずに服用するように指示すること。
PTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
本剤の投与にあたっては、具体的な服用方法、服用時の注意点、保管方法等を十分に説明し、本剤の目的以外への使用あるいは他人への譲渡をしないよう指導するとともに、本剤を子供の手の届かないところに保管するよう指導すること。
本剤が不要となった場合には、病院または薬局へ返却するなどの処置について適切に指導すること。
薬物動態
単回投与
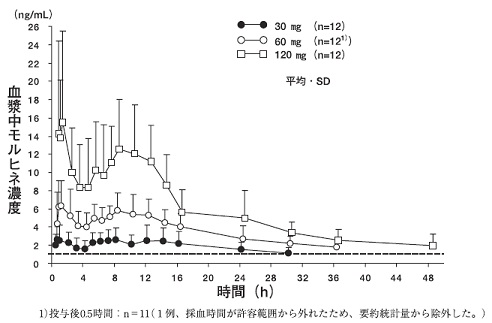
健康成人男子12例(外国人)を対象に、本剤30mg、60mg又は120mgを絶食下に単回経口投与した時の血中濃度の推移は図及び表1のとおりである。
反復投与
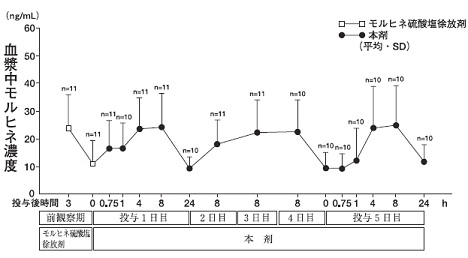
モルヒネ硫酸塩徐放剤30mgの1日2回投与により疼痛がコントロールされている癌患者11例に対し、本剤に切り替え1日1回60mgを5日間投与した時の血中濃度の推移は図のとおりである。
食事の影響
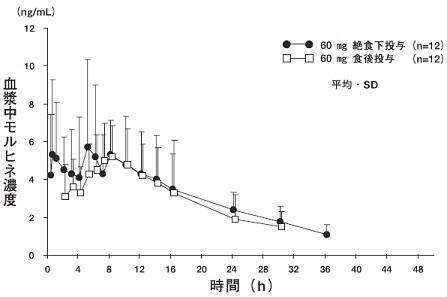
健康成人男子12例(外国人)に本剤60mgを朝食前絶食下又は高脂肪・高カロリー食(総カロリー:927kcal、総脂肪量59g)を摂食5分後に単回経口投与した時の血中濃度の推移は図及び表2のとおりである。
代謝
モルヒネは主として肝臓及び消化管粘膜に存在するUDP-glucuronyl transferaseにより代謝され、モルヒネ-3-グルクロニド(活性なし)及びモルヒネ-6-グルクロニド(活性あり)に代謝される。
排泄
既存の経口モルヒネ製剤30mg/日の投与により疼痛治療されている癌患者2例に対し、本剤に切り替え1日1回30mgを5日間投与した時の尿中排泄率は、モルヒネ-3-グルクロニドが64.5〜82.9%、モルヒネ-6-グルクロニドが7.3〜15.7%、モルヒネの未変化体が2.4〜5.8%である。
表1
| 投与量 | Cmax(ng/mL) | Cmax(ng/mL) | AUC(ng・h/mL) |
| 速放部 | 徐放部 | |
| 30mg | 3.50±1.42 | 3.99±1.32 | 61.1±35.5 |
| 60mg | 8.12±2.83 | 6.76±1.70 | 145±46.0 |
| 120mg | 20.6±10.2 | 14.6±5.00 | 275±99.1 |
| 投与条件 | Cmax(ng/mL) | Cmax(ng/mL) | AUC(ng・h/mL) |
| 速放部 | 徐放部 | |
| 絶食下 | 7.55±3.98 | 5.96±2.06 | 122±50.7 |
| 食後 | 4.56±1.19 | 6.75±1.61 | 100±46.8 |
臨床成績
二重盲検交差比較試験
モルヒネ硫酸塩徐放剤30mg又は60mgの1日2回投与により疼痛がコントロールされている癌患者61例を対象に、前治療でのモルヒネ投与量と同じ1日用量にて、本剤(1日1回投与)及びモルヒネ硫酸塩徐放剤(1日2回投与)を交互に4日間投与した二重盲検交差比較試験の結果、安静時疼痛のVAS(Visual Analogue Scale)(表1)を指標とした鎮痛効果において本剤の非劣性が確認されている。また、疼痛の程度、鎮痛と副作用を総合した治療の満足度、有痛時間及び睡眠時間においても薬剤間の差はみられていない。
長期投与試験
モルヒネによる疼痛治療が行われていない癌患者10例(新規例)及び既存の経口モルヒネ製剤の120mg/日以下の投与で疼痛治療されている癌患者78例(切替例)を対象に、新規例では30mg/日、切替例では30〜120mg/日より投与を開始し、1〜141日間投与した試験の結果、新規例では、安静時疼痛のVAS(表2)は投与2日目より低下し、その効果は投与終了時まで維持された。また、切替例では、切替前と切替後の安静時疼痛のVAS(表2)に違いはなく、切替前の効果が維持された。
| 前観察期 | 1.39±1.19cm |
| 本剤投与時 | 1.59±1.52cm |
| モルヒネ硫酸塩徐放剤投与時 | 1.46±1.39cm |
| 新規例 | 本剤投与前 | 4.51±2.05cm |
| 新規例 | 本剤投与後 | 1.51±1.61cm |
| 切替例 | 本剤投与前 | 2.23±1.97cm |
| 切替例 | 本剤投与後 | 1.96±1.81cm |
薬効薬理
鎮痛作用
本剤に含まれる徐放性粒と同じ放出制御システムであるプロトタイプの徐放性粒による鎮痛効果を水溶液による鎮痛効果と比較した(ラット:Tail-flick法)。
その結果、プロトタイプの徐放性粒(モルヒネ塩酸塩水和物として160mg/kg)を1日1回投与した時の鎮痛効果は、モルヒネ塩酸塩水和物水溶液(モルヒネ塩酸塩水和物として40mg/kg/回)を6時間毎に1日4回分割投与した時とほぼ同程度であった。また、この時同時に測定した血漿中モルヒネ濃度と鎮痛効果はほぼ同様に推移した。
作用機序
モルヒネは主に脊髄後角に存在するμ-受容体に作用して侵害刺激伝達を直接抑制し、更に脳のμ-受容体を介して中枢・延髄からの下行性の抑制系を活性化する。この直接的及び間接的な抑制作用により鎮痛作用を発現する。
その他、大脳辺縁系に作用して疼痛に伴う不安や恐怖といった情動反応を抑制し、また、大脳皮質における痛覚閾値を上昇させることも作用機序の一部として考えられている。
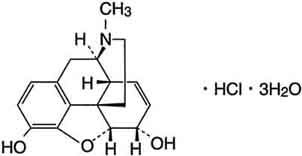
有効成分に関する理化学的知見
化学構造式
一般名
モルヒネ塩酸塩水和物(Morphine Hydrochloride Hydrate)〔JAN〕
化学名
(5R,6S)-4,5-Epoxy-17-methyl-7,8-didehydromorphinan-3,6-diol monohydrochloride trihydrate
分子式
C17H19NO3・HCl・3H2O
分子量
375.84
性状
モルヒネ塩酸塩水和物は白色の結晶又は結晶性の粉末である。ギ酸に溶けやすく、水にやや溶けやすく、メタノールにやや溶けにくく、エタノール(95)に溶けにくい。光によって徐々に黄褐色を帯びる。
包装
30mg:50カプセル(10カプセル×5)
60mg:50カプセル(10カプセル×5)
120mg:50カプセル(10カプセル×5)
主要文献及び文献請求先
文献請求先・製品情報お問い合わせ先
武田薬品工業株式会社 くすり相談室
*〒103-8668 東京都中央区日本橋本町二丁目1番1号
フリーダイヤル 0120-566-587
受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製造販売業者等の氏名又は名称及び住所
製造販売元
武田薬品工業株式会社
〒540-8645 大阪市中央区道修町四丁目1番1号