1
Kawakami N, et al.:Addict Behav. 1999;24(2):155-166
2
髙橋 三郎ほか訳:DSM-IV-TR 精神疾患の診断・統計マニュアル 新訂版 医学書院:259, 2004
3
Rigotti NA, et al.:Circulation. 2010;121(2):221-229
4
社内資料:心血管イベントに関する安全性メタ解析 [L20140410003]
5
Ware JH, et al.:Am J Ther. 2013;20(3):235-246
6
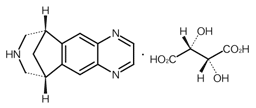
社内資料:自己摂取強化作用(2008年1月25日承認、CTD2.6.2.3(1)) [L20071105004]
7
社内資料:薬物乱用性に関する臨床薬理試験(2008年1月25日承認、CTD2.7.4.5.6) [L20071105005]
8
社内資料:ラットがん原性試験(2008年1月25日承認、CTD2.6.6.5(3)) [L20071105006]
9
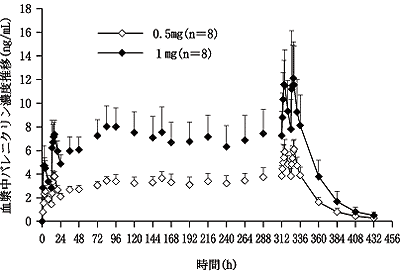
社内資料:健康成人における薬物動態(単回投与)(2008年1月25日承認、CTD2.5.3.1.1.1) [L20070928004]
10
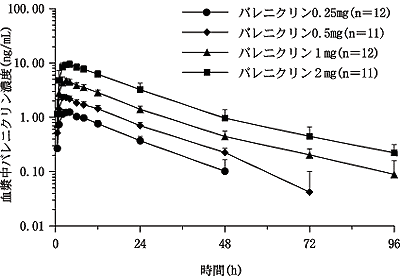
社内資料:健康成人における薬物動態(反復投与)(2008年1月25日承認、CTD2.5.3.1.1.1) [L20070928005]
11
社内資料:健康成人における薬物動態(食事の影響)(2008年1月25日承認、CTD2.7.1.2.1.2) [L20070928006]
12
Burstein AH, et al.:J Clin Pharmacol. 2006;46(11):1234-1240
13
社内資料:代謝物の検討(2008年1月25日承認、CTD2.6.4.5) [L20070928010]
14
社内資料:排泄の検討(2008年1月25日承認、CTD2.6.4.5、2.6.4.6) [L20070928011]
15
社内資料:健康喫煙者での代謝・排泄作用(2008年1月25日承認、CTD2.7.2.2.2.1.2.4)[L20070928007]
16
社内資料:腎機能障害患者での薬物動態(2008年1月25日承認、CTD2.7.2.3.2.4) [L20070928009]
17
社内資料:青少年における薬物動態(2008年1月25日承認、CTD2.7.2.3.2.2) [L20070928012]
18
社内資料:酵素阻害の検討(2008年1月25日承認、CTD2.6.4.5(3)、2.6.5.12) [L20070928013]
19
社内資料:腎クリアランス機構の検討(2008年1月25日承認、CTD2.6.4.6(4)、2.6.5.13) [L20070928014]
20
社内資料:シメチジンとの薬物相互作用(2008年1月25日承認、CTD2.7.2.2.4.3.1) [L20070928008]
21
社内資料:メトホルミンとの薬物相互作用(2008年1月25日承認、CTD2.7.2.2.4.3.2) [L20070928015]
22
社内資料:ジゴキシンとの薬物相互作用(2008年1月25日承認、CTD2.7.2.2.4.1.1) [L20070928016]
23
Burstein AH, et al.:J Clin Pharmacol. 2007;47(11):1421-1429
24
社内資料:ニコチン置換療法との薬物相互作用(2008年1月25日承認、CTD2.7.4.5.3.3.2) [L20070928018]
25
Nakamura M, et al.:Clin Ther. 2007;29(6):1040-1056
26
Oncken C, et al.:Arch Intern Med. 2006;166(15):1571-1577
27
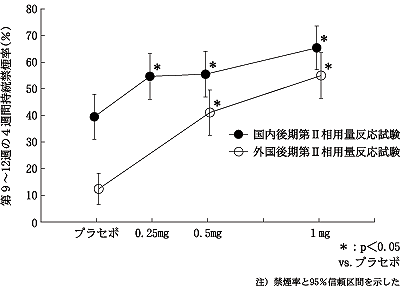
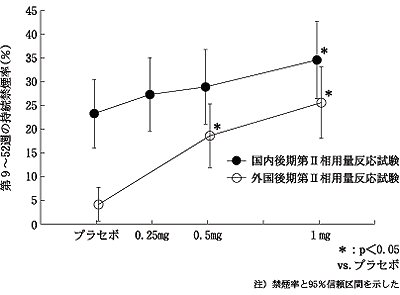
社内資料:外国後期第Ⅱ相用量反応試験(2008年1月25日承認、CTD2.7.3.3.2.1.6) [L20071205004]
28
社内資料:国内再投与試験(2008年1月25日承認、CTD2.7.4.1.1.3.1(2)) [L20071015066]
29
Gonzales D, et al.:JAMA. 2006;296(1):47-55
30
Jorenby DE, et al.:JAMA. 2006;296(1):56-63
31
社内資料:外国第Ⅲ相比較検証試験(2試験)(2008年1月25日承認、CTD2.7.3.2.3.1) [L20071205005]
32
Tonstad S, et al.:JAMA. 2006;296(1):64-71
33
社内資料:外国第Ⅲ相禁煙維持療法試験(2008年1月25日承認、CTD2.7.3.3.2.2.3) [L20071205006]
34
社内資料:ニコチン受容体結合作用(2008年1月25日承認、CTD2.6.2.2(1)) [L20070928019]
35
社内資料:種々の受容体結合作用(2008年1月25日承認、CTD2.6.2.2(1)) [L20070928020]
36
社内資料:ニコチン受容体の部分作動薬作用(2008年1月25日承認、CTD2.6.2.2(2)) [L20070928021]
37
社内資料:ニコチン受容体の部分作動薬作用(ドパミン遊離促進作用)(2008年1月25日承認、CTD2.6.2.2(2)) [L20070928022]
38
社内資料:ニコチン受容体の部分作動薬作用(ドパミン遊離抑制作用)(2008年1月25日承認、CTD2.6.2.2(2)) [L20070928023]
39
社内資料:ニコチン自己摂取抑制作用(2008年1月25日承認、CTD2.6.2.2(3)) [L20070928024]