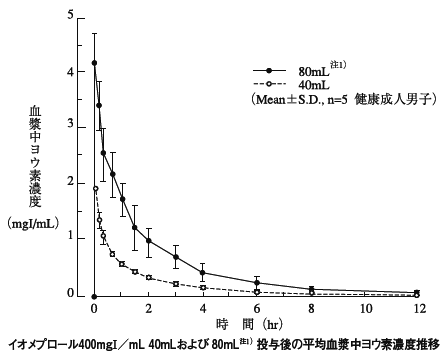
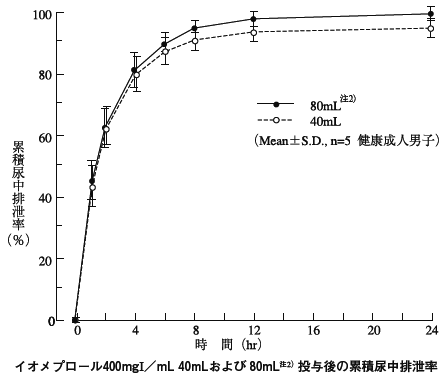
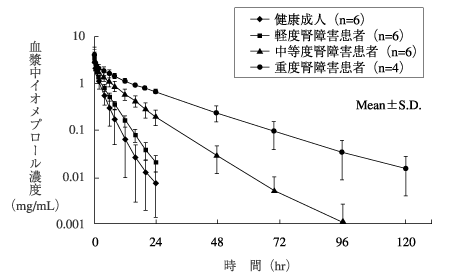
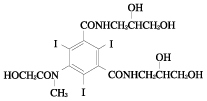
1
中島光好 他:臨床医薬. 1992;8:19-30[IOM-0103]
2
Lorusso V. et al.:Invest. Radiol. 2001;36:309-316[IOM-0269]
3
平松慶博 他:Prog. Med. 1995;15(3):340-348[IOM-0173]
4
平松慶博 他:Prog. Med. 1995;15(3):349-358[IOM-0174]
5
Katayama H. et al.:Eur. J. Radiol. 1994;18(S.1):115-119[IOM-0162]
6
粟井和夫 他:臨床医薬. 2008;24(6):575-597[IOM-0323]