1
隣谷義人 他:Therapeutic Research. 1989;10(Suppl.1):363-370
2
社内資料:注腸X線検査における有用性
3
社内資料:注腸造影検査における有用性ならびに安全性
4
第十七改正日本薬局方解説書 廣川書店 2016;C5859-C5862
ディスポーザブル注腸造影剤
1個 1743.1円
有効成分 | 1個中 硫酸バリウム 180g/300mL(60w/v%) |
|---|---|
添加剤 | アラビアゴム末、ポリリン酸ナトリウム、安息香酸、パラオキシ安息香酸エチル、パラオキシ安息香酸ブチル、プロピレングリコール、シリコーン樹脂、ソルビタン脂肪酸エステル、グリセリン脂肪酸エステル、ショ糖脂肪酸エステル、カルボキシメチルセルロースナトリウム、トラガント末 |
有効成分 | 1個中 硫酸バリウム 120g/400mL(30w/v%) |
|---|---|
添加剤 | アラビアゴム末、ポリリン酸ナトリウム、安息香酸、パラオキシ安息香酸エチル、パラオキシ安息香酸ブチル、プロピレングリコール、シリコーン樹脂、ソルビタン脂肪酸エステル、グリセリン脂肪酸エステル、ショ糖脂肪酸エステル、カルメロースナトリウム、キサンタンガム |
有効成分 | 1個中 硫酸バリウム 225g/300mL(75w/v%) |
|---|---|
添加剤 | アラビアゴム末、ポリリン酸ナトリウム、安息香酸、パラオキシ安息香酸エチル、パラオキシ安息香酸ブチル、プロピレングリコール、シリコーン樹脂、ソルビタン脂肪酸エステル、グリセリン脂肪酸エステル、ショ糖脂肪酸エステル、トラガント末、アルギン酸ナトリウム |
| 剤形・性状 | 注腸剤(液状) 振り混ぜるとき白色の懸濁液で、においはない。 |
|---|---|
| 外形 (全長約cm) | 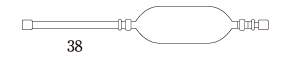 |
| pH | 約5 |
| 剤形・性状 | 注腸剤(液状) 振り混ぜるとき白色の懸濁液で、においはない。 |
|---|---|
| 外形 (全長約cm) | 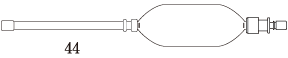 |
| pH | 約6 |
| 剤形・性状 | 注腸剤(液状) 振り混ぜるとき白色の懸濁液で、においはない。 |
|---|---|
| 外形 (全長約cm) | 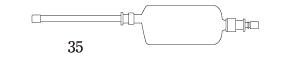 |
| pH | 約5.5 |
頻度不明 | |
|---|---|
消化器 | 排便困難、便秘、一過性の下痢・腹痛、肛門部痛・出血、悪心、嘔吐 |
過敏症 | 発疹、そう痒感、蕁麻疹 |