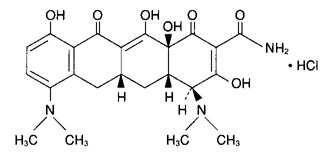
1
社内資料:承認申請時の概要 ヘ 吸収、分布
2
里見綾子 他.:日歯周誌. 1987;29(3):937-943
3
村山洋二 他.:日歯周誌. 1988;30(1):206-222
4
上田雅俊 他.:日歯周誌. 1988;30(1):223-235
5
石川烈 他.:日歯保誌. 1988;31(2):636-648
6
小林稔 他.:Jpn J Antibiot. 1972;25(5):283-287
7
中島光一 他.:日歯周誌. 1987;29(2):463-471
8
前原玲子 他.:日歯周誌. 1988;30(1):182-190