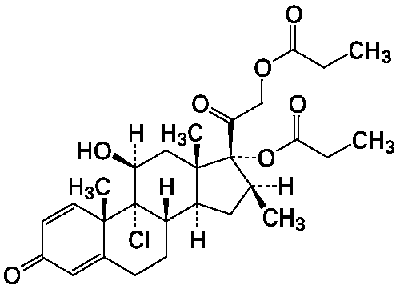
1
社内資料: 喘息患者でのHPA系抑制用量反応性試験(2002年4月11日承認、申請資料概要へ-3)
2
社内資料: 喘息患者での肺への分布(2002年4月11日承認、申請資料概要へ-3)
3
Harrison, L. I., et al.: Eur. J. Clin. Pharmacol. 2002; 58: 197-201
4
Teramoto, T., et al.: Allergol. Int.2006; 55: 317-320
5
宮本昭正: アレルギー・免疫. 2002; 9: 1088-1100
6
宮本昭正ほか: アレルギー・免疫. 2002; 9: 918-932
7
宮本昭正: アレルギー・免疫. 2002; 9: 934-945
8
西間三馨ほか: アレルギー・免疫. 2005; 12: 80-94
9
Harris, D. M.: Postgrad. Med. J. 1975; 51(Suppl. 4): 20-25
10
柳田知司ほか: 実中研・前臨床研究報. 1976; 2: 137-147
11
田中寿子ほか: 実中研・前臨床研究報. 1976; 2: 97-111
12
田中寿子ほか: 実中研・前臨床研究報. 1976; 2: 113-135
13
山本慧: 日本薬理学雑誌. 1977; 73: 25-36