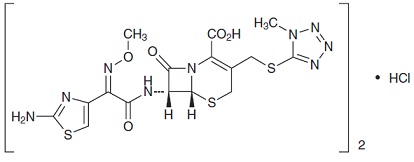
セフェム系抗生物質製剤
1瓶 742円
| 性状 | 白色〜淡黄色の粉末 |
|---|---|
| pH | 6.4〜7.9(10mL注射用水にて溶解時) |
| 浸透圧比(生理食塩液に対する比) | 約1(10mL注射用水にて溶解時) |
| 性状 | 白色〜淡黄色の粉末 |
|---|---|
| pH | 6.4〜7.9(20mL注射用水にて溶解時) |
| 浸透圧比(生理食塩液に対する比) | 約1(20mL注射用水にて溶解時) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 利尿剤 フロセミド等 | 他のセフェム系抗生物質で併用による腎障害増強作用が報告されているので、併用する場合には腎機能に注意すること。 | 機序は不明であるが、利尿時の脱水による血中濃度の上昇等が考えられている。 |
| エタノール(飲酒) | 飲酒等のエタノール摂取により、紅潮、悪心、頻脈、多汗、頭痛等があらわれることがあるので、投与期間中及び投与後少なくとも1週間は飲酒等のエタノール摂取を避けること。 | エタノール摂取24時間前に本剤を投与した試験(健康成人)で血中アセトアルデヒドの蓄積とジスルフィラム様作用が認められている。3) |
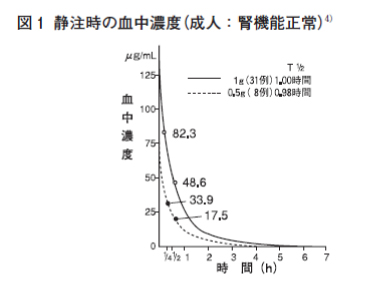
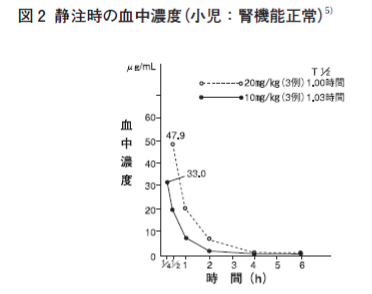
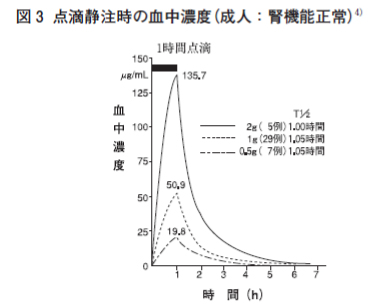
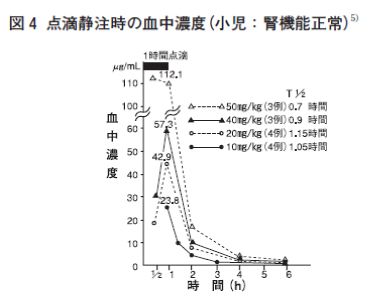
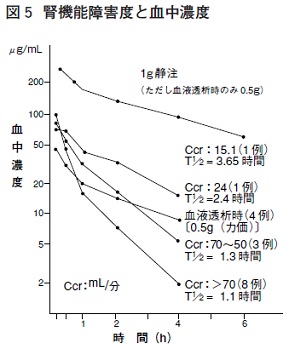
| 感染症 | 有効率(有効以上) 例数 | 有効率(有効以上) % |
| 敗血症 | 233/380 | 61.3 |
| 外傷・熱傷及び手術創等の二次感染 | 178/221 | 80.5 |
| 急性気管支炎、慢性呼吸器病変の二次感染 | 625/717 | 87.2 |
| 肺炎 | 2,428/2,899 | 83.8 |
| 肺膿瘍、膿胸 | 134/165 | 81.2 |
| 膀胱炎 | 472/577 | 81.8 |
| 腎盂腎炎 | 1,112/1,258 | 88.4 |
| 腹膜炎 | 357/404 | 88.4 |
| 胆嚢炎 | 363/393 | 92.4 |
| 胆管炎 | 202/227 | 89.0 |
| 肝膿瘍 | 28/39 | 71.8 |
| バルトリン腺炎 | 8/8 | − |
| 子宮内感染 | 29/37 | 78.4 |
| 子宮付属器炎 | 31/33 | 93.9 |
| 子宮旁結合織炎 | 28/36 | 77.8 |
| 計 | 6,228/7,394 | 84.2 |
| 感染症 | 有効率(有効以上) 例数 | 有効率(有効以上) % |
| 敗血症 | 18/28 | 64.3 |
| 外傷・熱傷及び手術創等の二次感染 | 3/6 | − |
| 急性気管支炎、慢性呼吸器病変の二次感染 | 9/10 | 90.0 |
| 肺炎 | 67/76 | 88.2 |
| 肺膿瘍、膿胸 | 2/2 | − |
| 腎盂腎炎 | 13/14 | 92.9 |
| 腹膜炎 | 23/24 | 95.8 |
| 胆嚢炎 | 2/2 | − |
| 胆管炎 | 3/3 | − |
| 子宮付属器炎 | 1/1 | − |
| 化膿性髄膜炎 | 1/1 | − |
| 計 | 142/167 | 85.0 |