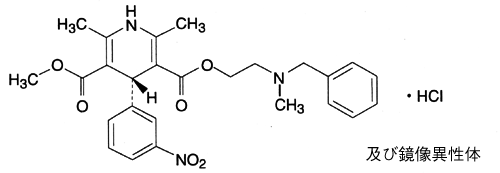
1
厚生省薬務局企画課監修: 医薬品相互作用ハンドブック. 薬業時報社 ; 1996. 96[PD-04034]
2
Physician’s Desk Reference 51Ed. Med. Econom. Co., Montvale ; 1995. 2815-2817[PD-10382]
3
松田重三 編: この薬の多剤併用副作用. 医歯薬出版 ; 1994. 76-79[HY-00205]
4
清水宏志 他: 基礎と臨床 1992; 26(5): 1681-1695[PD-01514]
5
西田真希 他: 臨床麻酔 1999; 23(11): 1793-1794[PD-09119]
6
伊賀立二 他: 治療 1994; 76(9): 2322-2327[PM-01395]
7
Capewell, S. et al.: Lancet 1988; 2: 480-482[PD-04037]
8
Woodcock, B. G. et al.: N. Engl. J. Med. 1991; 325(16): 1179[PD-04038]
9
松田重三 編: この薬の多剤併用副作用. 医歯薬出版 ; 1994. 96-99[PD-10364]
10
Higuchi, S. et al.: Xenobiotica. 1980; 10(6): 447-454[PD-01590]
11
江畑俊哉 他: 臨床麻酔 1985; 9(9): 1071-1075[PD-09773]
12
千代孝夫 他: 薬理と治療 1995; 23(3): 717-727[PD-03043]
13
平沢邦彦 他: 薬理と治療 1995; 23(4): 901-911[PD-03113]
14
Higuchi, S. et al.: Xenobiotica. 1980; 10(12): 889-896[PD-01589]
15
社内報告書(全身麻酔下患者・蛋白結合)(D199700856-01.00, 1997)
16
椎名 明 他: 基礎と臨床 1986; 20(2): 1114-1124[PD-00192]
17
Fukunaga, Y. et al.: ISSX Proceedings 1998; 13: 62[PD-09954]
18
田中陽一 他: 臨床麻酔 1983; 7(10): 1399-1405[PD-0892]
19
石井 奏 他: 基礎と臨床 1986; 20(1): 503-506[PD-00194]
20
吉矢生人 他: 麻酔 1986; 35(4): 520-527[SJI-00162]
21
松本信夫 他: 循環制御 1986; 7(2): 737-744[PD-00706]
22
佐久間祝子 他: 臨床麻酔 1985; 9(4): 407-412[PD-00855]
23
玉井 直 他: 麻酔 1986; 35(4): 528-539[SJI-00160]
24
吉永 馨 他: 薬理と臨床 1993; 3(3): 245-263[PD-01817]
25
吉永 馨 他: 医学のあゆみ 1993; 165(7): 437-456[PD-01801]
26
木之下正彦 他: 薬理と治療 1995; 23(2): 345-355[PD-03002]
27
弘田雄三 他: 薬理と治療 1995; 23(2): 357-374[PD-03003]
28
久萬田俊明 他: 薬理と治療 1995; 23(2): 375-398[PD-03004]
29
弘田雄三 他: 薬理と治療 1995; 23(3): 703-716[PD-03044]
30
小川 宏 他: 薬理と治療 1995; 23(4): 887-900[PD-03114]
31
Terai, M. et al.: Biochem. Pharmacol. 1981; 30: 375-378[PD-01328]
32
Bristow, M.R. et al.: Br. J. Pharmacol. 1984; 82(2): 309-320[PD-05313]
33
柴崎雅之 他: 基礎と臨床 1985; 19(14): 7044-7052[PD-00201]
34
佐藤修一 他: 薬理と臨床 1993; 3(4): 309-315[PD-02090]
35
竹中登一 他: 基礎と臨床 1980; 14(14): 4477-4494[PD-00377]
36
柴崎雅之 他: 基礎と臨床 1986; 20(1): 177-180[PD-00196]
37
柴崎雅之 他: 基礎と臨床 1988; 22(18): 6327-6332[SJA-01210]
38
田中秀行 他: 薬理と臨床 1995; 5(3): 371-379[PD-04077]
39
齋藤 親 他: 薬理と臨床 1995; 5(3): 381-388[PD-04076]
40
Hof, R.P.: Br. J. Pharmacol. 1983; 78 : 375-394[PD-01313]
41
小杉 功 他: 基礎と臨床 1979; 13(4): 1186-1190[PD-00402]
42
42)百瀬 隆: 基礎と臨床 1986; 20(7): 3867-3872[SJI-00214]