1
社内資料:海外臨床試験(点滴静注用製剤)における悪性腫瘍発現頻度
2
Hirota H, et al. Cell. 1999;97:189-98.
3
Abdel-Razzak Z, et al. Mol Pharmacol. 1993;44:707-15.
4
Muntané-Relat J, et al. Hepatology. 1995;22:1143-53.
5
Pascussi JM, et al. Biochem Biophys Res Commun. 2000;274:707-13.
6
肝組織を用いた代謝薬物相互作用試験(2008年04月16日承認、アクテムラ点滴静注用80mg,同200mg,同400mg申請資料概要2.7.2.2.1.1)
7
Rivory LP, et al. Br J Cancer. 2002;87:277-80.
8
Warren GW, et al. J Interferon Cytokine Res. 2001;21:821-6.
9
寺尾公男, 他. 臨床薬理. 2007;38(Suppl):S236.
10
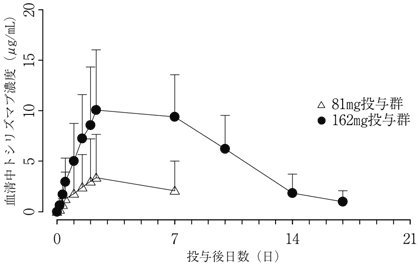
関節リウマチ患者を対象とした第I/Ⅱ相試験(MRA227JP)における薬物動態(2013年03月25日承認、申請資料概要2.7.2.2.1)
11
Ogata A, et al. Arthritis Care Res. 2014;66:344-54.
12
Ogata A, et al. Mod Rheumatol. 2018;28:76-84.
13
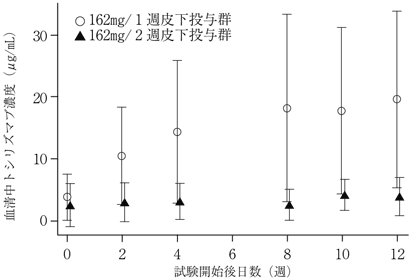
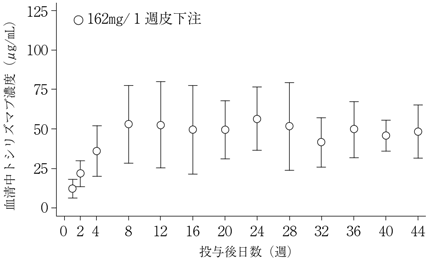
高安動脈炎患者を対象とした第Ⅲ相臨床試験(MRA632JP試験)における薬物動態(2017年08月25日承認、申請資料概要2.7.2.2.1)
14
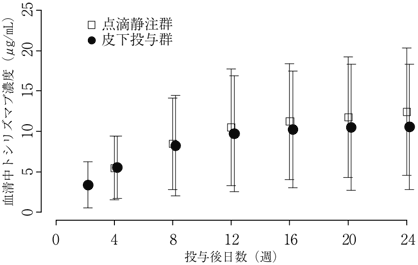
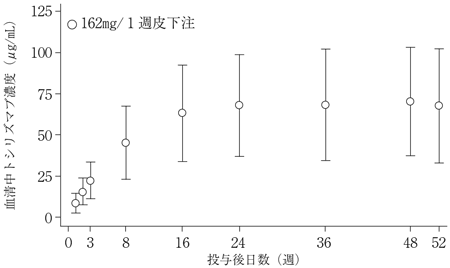
巨細胞性動脈炎患者を対象とした第Ⅲ相臨床試験(WA28119試験)における薬物動態(2017年08月25日承認、申請資料概要2.7.2.2.2)
15
関節リウマチ患者を対象とした第Ⅲ相二重盲検並行群間比較試験(MRA229JP試験)(2013年03月25日承認、申請資料概要2.7.3.3.2.5)
16
社内資料:関節リウマチ患者を対象とした第Ⅲ相二重盲検並行群間比較試験(MRA231JP試験)
17
Kivitz A, et al. Arthritis Care Res(Hoboken). 2014;66:1653-61.
18
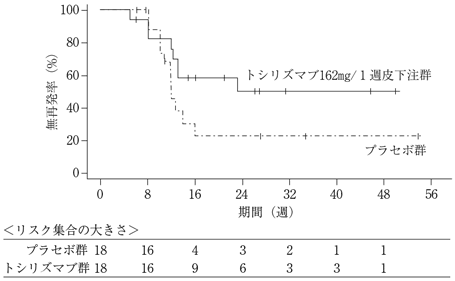
社内資料:高安動脈炎患者を対象とした第Ⅲ相臨床試験(MRA632JP試験)
19
巨細胞性動脈炎患者を対象とした第Ⅲ相臨床試験(WA28119試験)(2017年08月25日承認、申請資料概要2.7.3.2.2)
20
Mihara M, et al. Int Immunopharmacol. 2005;5:1731-40.
21
Shinkura H, et al. Anticancer Res. 1998;18:1217-21.
22
Mihara M, et al. Clin Immunol. 2001;98:319-26.
23
Uchiyama Y, et al. Biol Pharm Bull. 2008;31:1159-63.
24
Katsume A, et al. Cytokine. 2002;20:304-11.