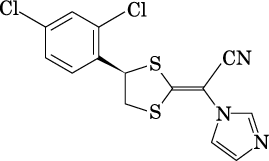
1
社内資料:ルリコナゾールの雌性ラットにおける乳汁中移行(ルリコンクリーム1%/ルリコン液1%、承認年月日:2005年4月11日、申請資料概要へ2.(4)4))
2
社内資料:爪白癬患者を対象とした5%ルリコナゾール外用液剤の爪内移行性確認試験(ルコナック爪外用液5%、承認年月日:2016年1月22日、CTD2.7.2.2.2.3)
3
社内資料:爪への単回及び反復塗布試験(ルコナック爪外用液5%、承認年月日:2016年1月22日、CTD2.7.2.2.2.2)
4
Watanabe S, et al.:J. Dermatol. 2017;44:753-759
5
社内資料:オープンパッチテスト・光パッチテストによる皮膚安全性の検討(ルコナック爪外用液5%、承認年月日:2016年1月22日、CTD2.7.2.2.2.1)
6
Niwano Y, et al.:Med. Mycol. 1999;37:351-355
7
社内資料:ルリコナゾールの白癬菌保存株に対するin vitro抗真菌及び殺真菌活性(ルコナック爪外用液5%、承認年月日:2016年1月22日、CTD2.6.2.1)
8
Koga H, et al.:J. Infect. Chemother. 2006;12:163-165
9
島村剛ほか:Med. Mycol. J. 2016;57:J13-J18