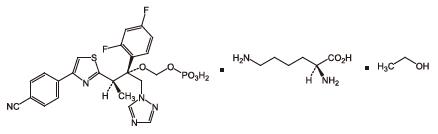
経口抗真菌剤
1カプセル 814.8円
| 色・剤形 | キャップ部は赤色及びボディ部は黄色の3号硬カプセル |
|---|---|
| 外形・大きさ | 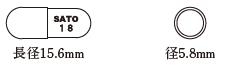 |
| 識別コード | SATO 18(カプセル、PTPシートに表示) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| CYP3Aにより主に代謝される薬剤 シンバスタチン ミダゾラム 等 | これらの薬剤の血中濃度を上昇させる可能性がある。[「薬物動態」の項参照] | ラブコナゾールのCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ワルファリン | ワルファリンの作用が増強し、著しいINR上昇があらわれることがある。[「重要な基本的注意」の項参照] | アゾール系抗真菌剤でINR上昇が報告されている。 |
| 10%以上 | 1%〜10% | 1%未満 | 頻度不明 | |
| 消化器 | 腹部不快感、便秘 | 消化不良、腹部膨満、上腹部痛、びらん性胃炎 | 悪心、嘔吐、下痢、食欲不振、口渇 | |
| 皮膚 | 円形脱毛症、皮脂欠乏性湿疹、痒疹 | 発疹、湿疹、紅斑 | ||
| 臨床検査 | γ-GTP増加 | ALT(GPT)増加、AST(GOT)増加、血中Al-P増加 | 白血球数減少、白血球数増加、赤血球数減少、血中クレアチニン増加、ヘモグロビン減少 | 血中LDH増加 |
| その他 | 口角口唇炎 | 膀胱炎、高尿酸血症 | 倦怠感、めまい |
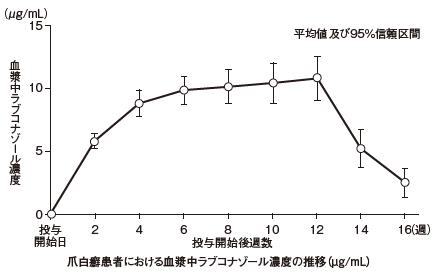
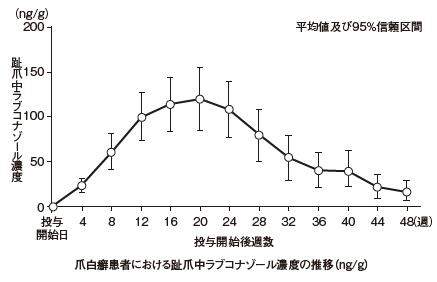
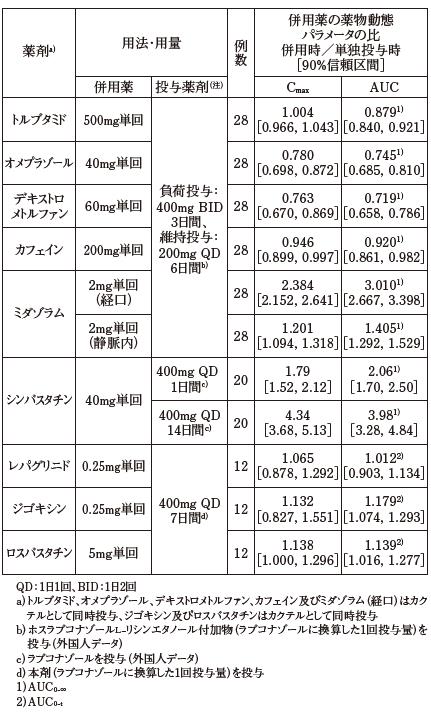
| 用量(注2) | 統計量 | Cmax (μg/mL) | Tmax (h) | AUC0-t (μg・h/mL) | t1/2 (h) |
| 100mg | 平均値 標準偏差 | 2.17 0.43 | 2.50 1.22 | 109 21 | 71.17 35.02 |
| 200mg | 平均値 標準偏差 | 4.38 0.40 | 2.50 0.84 | 268 105 | 94.44 32.64 |
| 400mg | 平均値 標準偏差 | 7.49 1.29 | 3.33 1.51 | 542 141 | 80.18 15.41 |
| 600mg | 平均値 標準偏差 | 10.88 1.29 | 2.67 0.52 | 946 216 | 100.87 55.14 |
| 投与群 | 爪白癬治癒率 (爪白癬治癒症例数/有効性解析対象症例数) | Fisherの直接確率計算法 |
| 本剤群 | 59.4%(60/101例) | P<0.001 |
| プラセボ群 | 5.8%(3/52例) | P<0.001 |
| 菌種(株数) | MIC(μg/mL) 範囲 | MIC(μg/mL) MIC50 | MIC(μg/mL) MIC90 |
| T.rubrum(51) | ≦0.03 - 0.12 | ≦0.03 | 0.06 |
| T.mentagrophytes(20) | ≦0.03 - 0.06 | ≦0.03 | 0.06 |