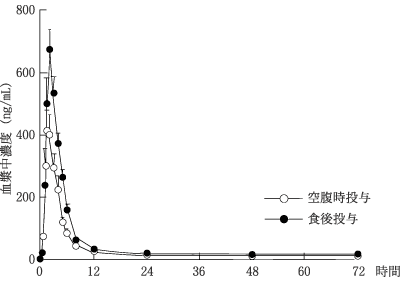
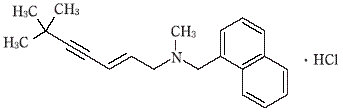
アリルアミン系経口抗真菌剤
1錠 95.2円
| 性状 | 白色〜淡黄白色の片面割線入りの素錠 |
|---|---|
| 外形 | 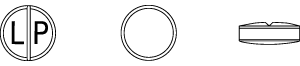 |
| 識別コード | LP |
| 大きさ(約) | 直径:9.0mm 厚さ:3.7mm 質量:0.21g |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| (1)シメチジン (2)フルコナゾール | 本剤の血中濃度が上昇するとの報告があるので、併用する場合には用量に注意すること。 | これらの薬剤によるチトクロームP450の抑制により本剤の代謝が遅延する。 |
| リファンピシン | 本剤の血中濃度が低下するとの報告があるので、併用する場合には用量に注意すること。 | リファンピシンによる肝代謝酵素の誘導により、本剤の代謝が促進される。 |
| (1)三環系抗うつ剤(イミプラミン、ノルトリプチリン、アミトリプチリン) (2)マプロチリン (3)デキストロメトルファン | これらの薬剤又はその活性代謝物の血中濃度が上昇することがあるので、併用する場合には用量に注意すること。 | 本剤のCYP2D6の阻害により、これらの薬剤又はその活性代謝物の代謝が遅延する。 |
| 黄体・卵胞ホルモン混合製剤(経口避妊薬等) | 月経異常があらわれたとの報告があるので注意すること。 | 機序不明。 |
| シクロスポリン | シクロスポリンの血中濃度が低下したとの報告があるので、併用する場合にはシクロスポリンの血中濃度を参考にシクロスポリンの投与量を調節すること。特に、移植患者では拒絶反応の発現に注意すること。 | 機序不明。 |