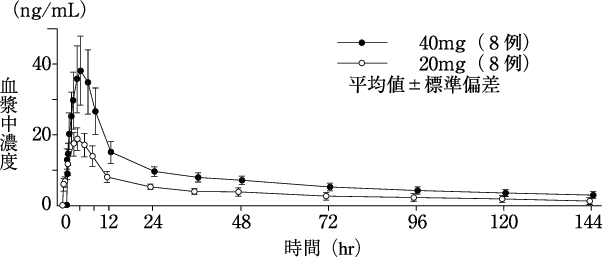
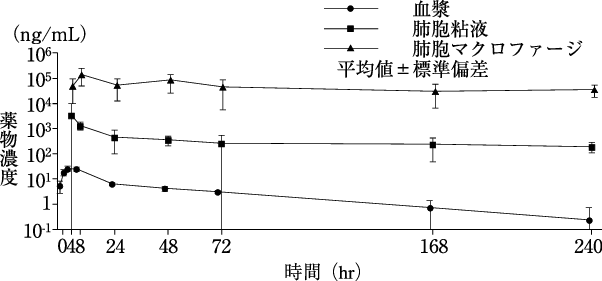
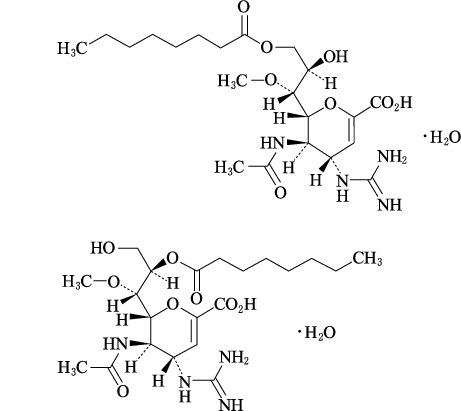
1
Yoshiba S, et al.:J Bioequiv Availab. 2011;3(1):001-004
2
Ishizuka H, et al.:Antimicrob Agents Chemother. 2012;56(7):3873-3878
3
Ishizuka H, et al.:J Clin Pharmacol. 2011;51(2):243-251
4
Watanabe A, et al.:Clin Infect Dis. 2010;51(10):1167-1175
5
Sugaya N, et al.:Antimicrob Agents Chemother. 2010;54(6):2575-2582
6
社内資料:CS-8958第Ⅲ相試験-未成年(10歳代)のインフルエンザウイルス感染症患者を対象とした無作為化二重盲検比較試験-(2010年9月10日承認、CTD2.7.6.13)
7
Kashiwagi S, et al.:Clin Infect Dis. 2016;63(3):330-337
8
Kashiwagi S, et al.:J Infect Chemother. 2013;19(4):740-749
9
社内資料:10歳未満の小児を対象にインフルエンザウイルス感染症発症抑制効果の検証を目的としたプラセボとの無作為化二重盲検比較試験
10
Watanabe A.:J Infect Chemother. 2013;19(1):89-97
11
Yamashita M, et al.:Antimicrob Agents Chemother.2009;53(1):186-192
12
Itoh Y, et al.:Nature. 2009;460(7258):1021-1025
13
Kiso M, et al.:PLoS Pathog. 2010;6(2):e1000786
14
Kubo S, et al.:Antimicrob Agents Chemother. 2010;54(3):1256-1264
15
社内資料:フェレット感染モデルにおける抗ウイルス作用(2010年9月10日承認、CTD2.6.2.2)