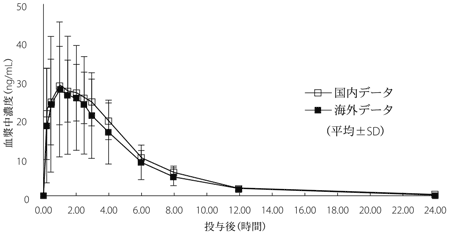
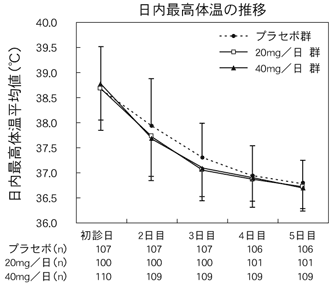
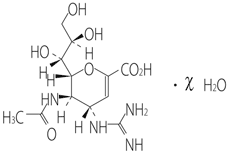
1
Cass LMR,et al.:Clin Pharmacokinet.1999;36(Suppl.1):1-11
2
Daniel MJ,et al.:Clin Pharmacokinet.1999;36(Suppl.1):41-50
3
Hedrick JA,et al.:Pediatr Infect Dis J.2000;19:410-417
4
von Itzstein M,et al.:Nature.1993;363:418-423
5
Woods JM,et al.:Antimicrob Agents Chemother.1993;37:1473-1479
6
Gubareva LV,et al.:Virology.1995;212:323-330
7
Ryan DM,et al.:Antimicrob Agents Chemother.1994;38:2270-2275
8
Ryan DM,et al.:Antimicrob Agents Chemother.1995;39:2583-2584
9
Barnett JM,et al.:Antimicrob Agents Chemother.2000;44:78-87
10
Boivin G,et al.:J Infect Dis.2000;181:1471-1474
11
Hayden FG,et al.:N Engl J Med.2000;343:1282-1289
12
Gubareva LV,et al.:J Infect Dis.1998;178:1257-1262