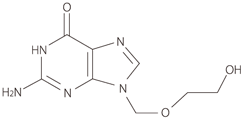
1
Stahlmann R,et al.:Infection.1987;15:261-262
2
Laskin OL,et al.:Antimicrob Agents Chemother.1982;21:804-807
3
De Bony F,et al.:Antimicrob Agents Chemother.2002;46:458-463
4
Bullingham RES,et al.:Clin Pharmacokinet.1998;34:429-455
5
Maeda Y,et al.:Biol Pharm Bull.1996;19:1591-1595
6
Davis RL,et al.:Program and Abstracts of the 31st Interscience Conference on Antimicrobial Agents and Chemotherapy.1991;226
7
笹 征史ほか:臨床薬理.1983;14:471-479
8
Perry CM,et al.:Drugs.1996;52:754-772
9
Spector SA,et al.:Am J Med.1982;73(1A):275-280
10
Blum MR,et al.:Am J Med.1982;73(1A):186-192
11
Lau RJ,et al.:Obstet Gynecol.1987;69:468-471
12
Laskin OL,et al.:Am J Med.1982;73(1A):197-201
13
Hintz M,et al.:Am J Med.1982;73(1A):210-214
14
Cheng Y,et al.:Drug Metab Dispos.2012;40:617-624
15
Takeda M,et al.:J Pharmacol Exp Ther.2002;300:918-924
16
Nies AT,et al.:Expert Opin Drug Metab Toxicol.2012;8:1565-1577
17
Tanihara Y,et al.:Biochem Pharmacol.2007;74:359-371
18
Yeager AS:Am J Med.1982;73(1A):205-209
19
Biron KK,et al.:Antimicrob Agents Chemother.1980;18:443-447
20
Biron KK,et al.:Herpesvirus NY,NY:Alan R Liss,Inc.;1984:677-685
21
Furman PA,et al.:J Virol.1979;32:72-77
22
Furman PA,et al.:Antimicrob Agents Chemother.1981;20:518-524
23
St Clair MH,et al.:Antimicrob Agents Chemother.1980;18:741-745
24
Miller WH,et al.:J Biol Chem.1980;255:7204-7207
25
Al-Hasani AM,et al.:J Antimicrob Chemother.1986;18(Suppl.B):113-119
26
McLaren C,et al.:Am J Med.1982;73(1A):376-379
27
武藤茂生ほか:小児科臨床.1983;36:2785-2790
28
Machida H:Antimicrob Agents Chemother.1986;29:524-526