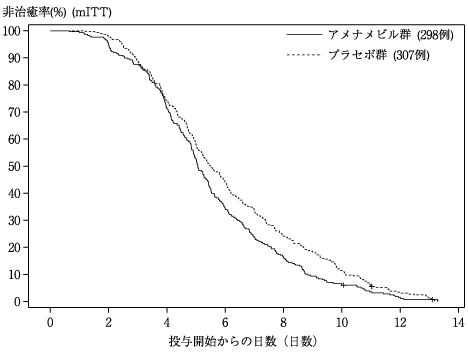
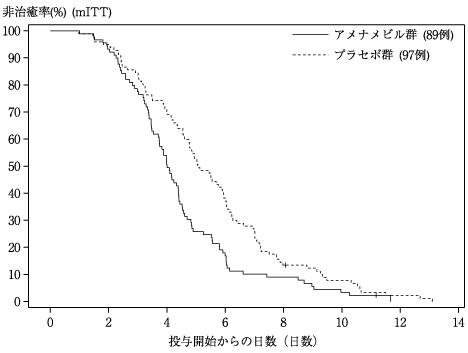
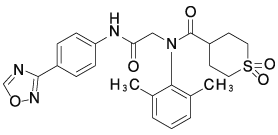
1
社内資料:胎盤移行性・乳汁移行性試験(マウス)(2017年7月3日承認、CTD2.6.4.4.4.1、2.6.4.6.3.1)[11111111-1821]
2
社内資料:代謝に関与するCYP分子種の検討(in vitro)(2017年7月3日承認、CTD2.6.4.5.1.4、2.6.4.5.2.1、2.6.4.7.1.1、2.6.4.7.2)[11111111-1820]
3
Kusawake T., et al.:Adv. Ther. 2017; 34(12): 2625-2637[11111111-1897]
4
社内資料:健康成人を対象とした単回投与試験(2017年7月3日承認、CTD2.7.6.4)[11111111-1822]
5
社内資料:母集団薬物動態解析(2017年7月3日承認、CTD2.5.3.1.4)[11111111-1825]
6
社内資料:たん白結合に関する薬物動態試験(in vitro)(2017年7月3日承認、CTD2.6.4.4.2)[11111111-1819]
7
社内資料:血球移行性に関する薬物動態試験(in vitro)(2017年7月3日承認、CTD2.6.4.4.3.1)[11111111-1817]
8
Kato K., et al.:Clin. Pharmacol. Drug Dev. 2019; 8(5): 595-602[11111111-1930]
9
Kusawake T., et al.:Adv. Ther. 2017; 34(12): 2612-2624[11111111-1781]
10
Tsuruoka S., et al.:Adv. Ther. 2020; 37(7): 3234-3245[20201125-1001、20201015-0007]
11
社内資料:血液透析患者を対象とした単回投与試験[20201021-1001]
12
Adeloye T., et al.:Clin. Pharmacol. Drug Dev. 2018; 7(8): 844-859[20190630-0002]
13
Kusawake T., et al.:Adv. Ther. 2017; 34(11): 2466-2480[11111111-1909]
14
Dennison J., et al.:Clin. Pharmacol. Drug Dev. 2018; 7(8): 860-870[20180615-0003]
15
社内資料:トランスポーターに関する試験(2017年7月3日承認、CTD2.6.4.7.3)[11111111-1818]
16
Kawashima M., et al.:J. Dermatol. 2017; 44(11): 1219-1227[11111111-1778]
17
社内資料:帯状疱疹患者を対象とした国内第Ⅲ相試験(2017年7月3日承認、CTD2.7.6.22.2.4)[11111111-1824]
18
社内資料:再発性の口唇ヘルペス患者を対象とした国内第Ⅲ相試験[20221209-1001]
19
社内資料:再発性の性器ヘルペス患者を対象とした国内第Ⅲ相試験[20221209-1002]
20
社内資料:QT/QTc間隔への影響に関する試験(2017年7月3日承認、CTD2.7.6.20)[11111111-1834]
21
Chono K., et al.:J. Antimicrob. Chemother. 2010; 65: 1733-1741[11111112-1797]
22
社内資料:効力を裏付ける試験(2017年7月3日承認、CTD2.6.2.2.1.1、2.6.2.2.1.2)[20221209-1003]