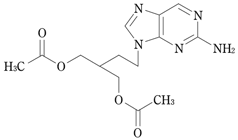
1
Boike, S. C., et al.:Clin.Pharmacol.Ther.1994;55(4):418-26
2
社内資料:A study to determine the pharmacokinetics of penciclovir following single and repeat dosing with famciclovir in healthy subjects and subjects with varying degrees of renal impairment.
3
社内資料:A study to determine the pharmacokinetics of penciclovir following single and repeat dosing with famciclovir in healthy subjects and subjects with varying degrees of renal impairment.
4
社内資料:ペンシクロビルの腎機能障害者における薬物動態
5
社内資料:ファムシクロビルの生殖毒性試験(2008年4月16日承認、申請資料概要二 3.2)
6
社内資料:ファムシクロビルのイヌ反復経口投与試験(2008年4月16日承認、申請資料概要二 2.6)
7
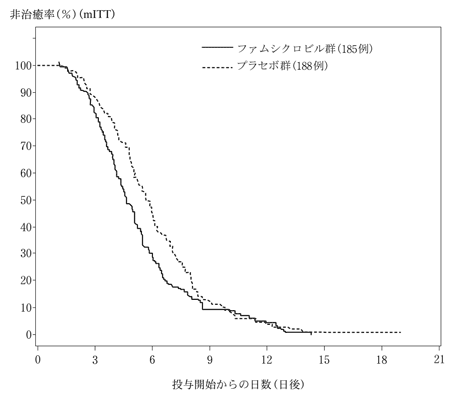
社内資料:ファムシクロビルの再発性器ヘルペス感染患者での試験(2008年4月16日承認、申請資料概要二 10.1)
8
社内資料:ファムシクロビルのラットがん原性試験(2008年4月16日承認、申請資料概要二 7.2)
9
社内資料:ファムシクロビルのマウスがん原性試験(2008年4月16日承認、申請資料概要二 7.1)
10
社内資料:ペンシクロビルの突然変異試験(2008年4月16日承認、申請資料概要二 6.2)
11
社内資料:ペンシクロビルの染色体異常試験(2008年4月16日承認、申請資料概要二 6.2)
12
社内資料:ペンシクロビルの小核試験(2008年4月16日承認、申請資料概要二 6.2)
13
社内資料:ペンシクロビルの小核閾値試験(2008年4月16日承認、申請資料概要二 6.2)
14
工藤 忍他:薬物動態 1996;11(6):547-55
15
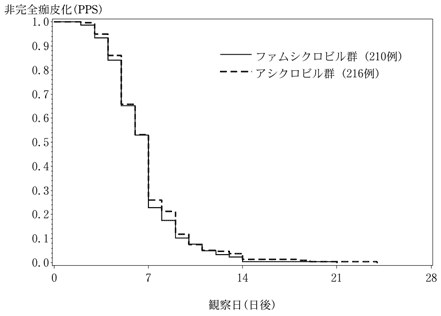
社内資料:ファムシクロビルの健康成人における生物学的利用率(2008年4月16日承認、申請資料概要へ 3.1)
16
工藤 忍他:薬理と治療 1996;24(7):117-27
17
Filer, C. W., et al.:薬理と治療,1996;24(8):159-83
18
社内資料:ペンシクロビルの血漿タンパク結合(2008年4月16日承認、申請資料概要へ 2.2)
19
社内資料:ペンシクロビルの血球移行性(2008年4月16日承認、申請資料概要へ 2.2)
20
Clarke, S., et al.:Drug Metab.Dispos.1995;23(2):251-4
21
Harrell, A. W., et al.:Drug Metab.Dispos.1993;21(1):18-23
22
Boike, S. C., et al.:J. Clin. Pharmacol.1994;34:1199-207
23
社内資料:ファムシクロビルの高齢者における薬物動態 (2008年4月16日承認、申請資料概要へ 3.2)
24
社内資料:シメチジン併用時におけるファムシクロビルの薬物動態(2008年4月16日承認、申請資料概要へ 3.5)
25
社内資料:アロプリノール併用時におけるファムシクロビルの薬物動態(2008年4月16日承認、申請資料概要へ 3.5)
26
社内資料:テオフィリン併用時におけるファムシクロビルの薬物動態(2008年4月16日承認、申請資料概要へ 3.5)
27
社内資料:ジゴキシンの薬物動態に対するファムシクロビル併用投与の影響(2008年4月16日承認、申請資料概要へ 3.5)
28
社内資料:定常状態におけるジゴキシンの薬物動態に対するファムシクロビル併用投与の影響(2008年4月16日承認、申請資料概要へ 3.5)
29
社内資料:プロメタジン併用投与におけるファムシクロビルの薬物動態(2008年4月16日承認、申請資料概要へ 3.5)
30
川島 眞他:臨床医薬 2013;29(3):285-307
31
川島 眞他:日臨皮会誌 2018;35(3):488-96
32
本田 まりこ他:臨床医薬 2008;24(9):825-48
33
Vere Hodge, R. A., et al.:Antimicrob.Agents Chemother.1989;33(2):223-9
34
Earnshaw, D. L., et al.:Antimicrob.Agents Chemother.1992;36(12):2747-57
35
Bacon, T. H., et al.:Antivir.Chem.Chemother.1996;7(2):71-8
36
Boyd, M. R., et al.:Antimicrob.Agents Chemother.1987;31(8):1238-42
37
社内資料:英国臨床分離株に対するペンシクロビルの抗ウイルス作用(2008年4月16日承認、申請資料概要ホ 1.1)
38
社内資料:英国及び米国臨床分離株に対するペンシクロビルの抗ウイルス作用 (2008年4月16日承認、申請資料概要ホ 1.1)
39
社内資料:英国、米国及びベルギー臨床分離株に対するペンシクロビルの抗ウイルス作用 (2008年4月16日承認、申請資料概要ホ 1.1)
40
社内資料:本邦臨床分離株に対するペンシクロビルの抗ウイルス作用 (2008年4月16日承認、申請資料概要ホ 1.1)
41
Boyd, M. R., et al.:Antivir.Chem.Chemother.1993;4(S1):3-11