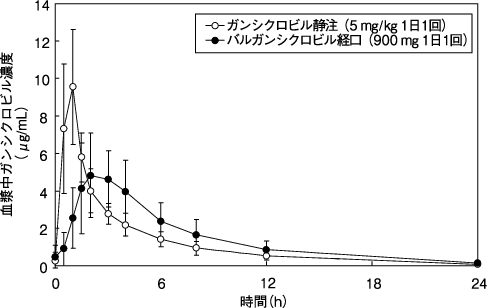
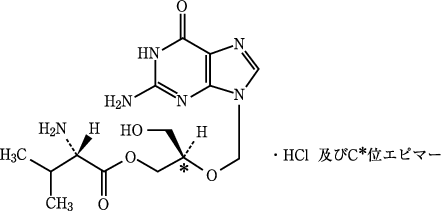
1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:バルガンシクロビル塩酸塩(サイトメガロウイルス感染症のリスクのある臓器移植後のサイトメガロウイルス感染予防・発症抑制(成人))
2
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:バルガンシクロビル塩酸塩(サイトメガロウイルス感染症のリスクのある小児(固形臓器)移植後のサイトメガロウイルス感染予防)
3
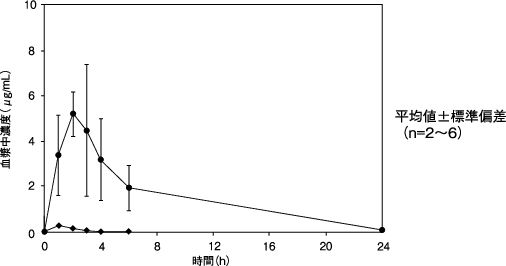
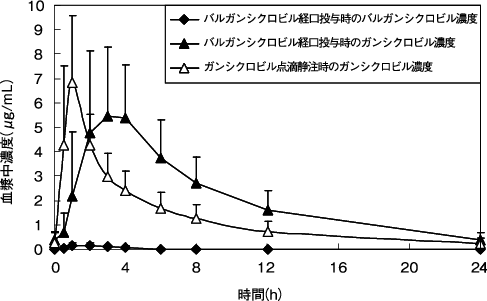
田辺三菱製薬(株):バリキサ錠450mg及びバリキサドライシロップ5000mgの生物学的同等性(社内資料)
4
田辺三菱製薬(株):症候性先天性CMV感染児を対象とした国内第Ⅲ相非盲検試験の薬物動態(社内資料)(2023年3月27日承認、CTD 2.7.2.2.2.1)
5
Brown F, et al.:Clin Pharmacokinet. 1999;37(2):167-176
6
Czock D, et al.:Clin Pharmacol Ther. 2002;72(2):142-150
7
Martin DF, et al.:N Engl J Med. 2002;346(15):1119-1126
8
Lalezari J, et al.:J Acquir Immune Defic Syndr. 2002;30(4):392-400
9
田辺三菱製薬(株):症候性先天性CMV感染児を対象とした国内第Ⅲ相非盲検試験(社内資料)(2023年3月27日承認、CTD 2.7.3.2.1、CTD 2.7.4.2.1)
10
Ashton WT, et al.:Biochem Biophys Res Commun. 1982;108(4):1716-1721
11
Smee DF, et al.:Mol Cell Biochem. 1985;69(1):75-81
12
Mar EC, et al.:J Virol. 1985;53(3):776-780
13
Cheng YC, et al.:Proc Natl Acad Sci U S A. 1983;80(9):2767-2770
14
Freitas VR, et al.:Antimicrob Agents Chemother. 1985;28(2):240-245
15
Plotkin SA, et al.:J Infect Dis. 1985;152(4):833-834
16
Field AK, et al.:Proc Natl Acad Sci U S A. 1983;80(13):4139-4143
17
Smith KO, et al.:Antimicrob Agents Chemother. 1982;22(1):55-61
18
Tocci MJ, et al.:Antimicrob Agents Chemother. 1984;25(2):247-252
19
Tatarowicz WA, et al.:J Infect Dis. 1992;166(4):904-907
20
Smith IL, et al.:J Infect Dis. 1997;176(1):69-77
21
Erice A, et al.:J Infect Dis. 1997;175(5):1087-1092
22
Jabs DA, et al.:J Infect Dis. 2001;183(2):333-337
23
Boivin G, et al.:J Infect Dis. 2001;184(12):1598-1602
24
Boivin G, et al.:J Infect Dis. 2004;189(9):1615-1618