1
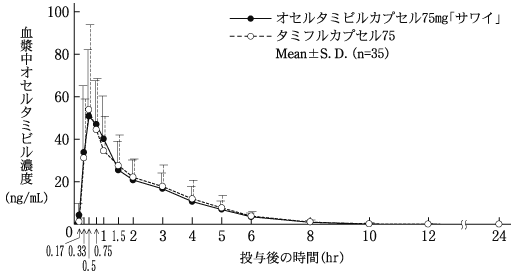
健康成人における単回投与試験(国内:JP15734)(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.3-1)
2
日本人と白人での反復投与試験(薬物動態直接比較試験)(海外:JP15735)(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.3-5)
3
米村拓麿他:新薬と臨床, 2018;67(4):389-401
4
臓器、組織内濃度(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.2-2-1)
5
血漿蛋白質との結合(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.2-2-4)
6
in vitro代謝(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.2-3-2)
7
乳汁中への移行(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.2-4-3)
8
Abe, M. et al.:Ann. Pharmacother., 2006;40:1724-1730
9
腎機能障害を伴う被験者による反復投与試験(海外:WP15648)(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.3-7-1)
10
in vitro薬物相互作用(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.2-3-5)
11
腎排泄型薬剤(シメチジン/プロベネシド)との薬物相互作用(海外:WP15728)(タミフルカプセル: 2000年12月12日承認、申請資料概要ヘ.3-8-2)
12
柏木征三郎他:感染症学雑誌, 2000;74:1044-1061
13
第Ⅲ相治療試験の安全性のまとめ(国内:JV15823)(タミフルカプセル: 2000年12月12日承認、申請資料概要ト.2-2-1)
14
第Ⅲ相治療試験の有効性のまとめ(海外:WV15670/15671/15730)(タミフルカプセル: 2000年12月12日承認、申請資料概要ト.1-3-2, ト.2-1-2)
15
柏木征三郎他:感染症学雑誌, 2000;74:1062-1076
16
第Ⅲ相予防試験の安全性のまとめ(国内:JV15824)(タミフルカプセル: 2004年7月9日承認、申請資料概要ト.2-2-1)
17
成人に対する第Ⅲ相予防試験(42日間投与)(海外:WV15673/15697)(タミフルカプセル: 2004年7月9日承認、申請資料概要ト.1-3-2)
18
高齢者に対する第Ⅲ相予防試験(42日間投与)(海外:WV15825)(タミフルカプセル: 2004年7月9日承認、申請資料概要ト.1-3-2)
19
第Ⅲ相予防試験(7日間投与)(海外:WV15799)(タミフルカプセル: 2004年7月9日承認、申請資料概要ト.1-3-2)
20
第Ⅲ相予防試験(10日間投与)(海外:WV16193)(タミフルカプセル: 2004年7月9日承認、申請資料概要ト.1-3-2)
21
ノイラミニダーゼ阻害作用(タミフルカプセル: 2000年12月12日承認、申請資料概要ホ-1.1)
22
ヒトインフルエンザA型及びB型ウイルスにおけるin vitro増殖抑制作用(タミフルカプセル: 2000年12月12日承認、申請資料概要イ.1-1-5, ホ-1.2)
23
Sidwell, R. W. et al.:Antiviral Res., 1998;37:107-120
24
Mendel, D. B. et al.:Antimicrob. Agents Chemother., 1998;42:640-646
25
動物モデルにおける効果:ニワトリ感染モデル(タミフルカプセル: 2000年12月12日承認、申請資料概要ホ-1.3-3)
26
耐性(タミフルカプセル: 2004年7月9日承認、申請資料概要ト.1-4)