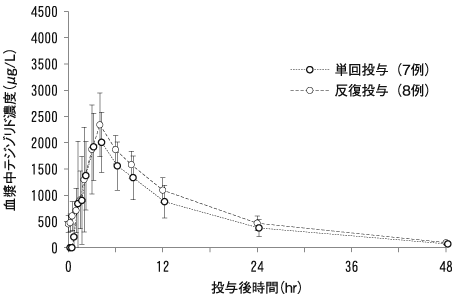
1
Flanagan S, et al. Antimicrob Agents Chemother. 2014; 58(11): 6462-70.
2
Betriu C, et al. Antimicrob Agents Chemother. 2010; 54(5): 2212-5.
3
Louie A, et al. Antimicrob Agents Chemother. 2011; 55(7): 3453-60.
4
Tessier PR, et al. Antimicrob Agents Chemother. 2012; 56(5): 2342-6.
5
Choi S, et al. Antimicrob Agents Chemother. 2012; 56(9): 4713-7.
6
Drusano GL, et al. Antimicrob Agents Chemother. 2011; 55(11): 5300-5.
7
Livermore DM, et al. J Antimicrob Chemother. 2009; 63(4): 713-5.
8
Locke JB, et al. Antimicrob Agents Chemother. 2010; 54(12): 5337-43.
9
Locke JB, et al. Antimicrob Agents Chemother. 2009; 53(12): 5265-74.