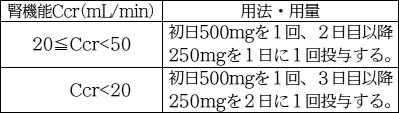
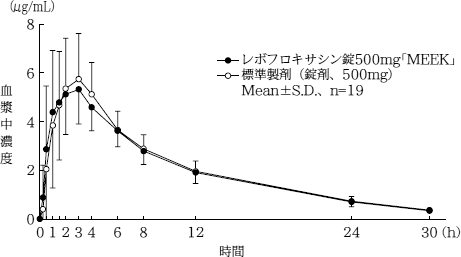
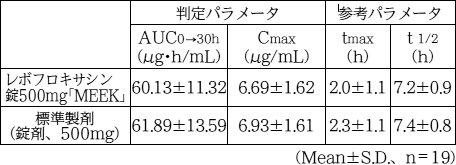
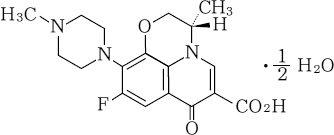
ショック、アナフィラキシー
(頻度不明)
ショック、アナフィラキシー(初期症状:紅斑、悪寒、呼吸困難等)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)
(頻度不明)
中毒性表皮壊死融解症、皮膚粘膜眼症候群があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
痙攣
(頻度不明)
痙攣があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
QT延長、心室頻拍(Torsades de pointesを含む)
(頻度不明)
QT延長、心室頻拍(Torsades de pointesを含む)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
急性腎障害、間質性腎炎
(頻度不明)
急性腎障害、間質性腎炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
劇症肝炎、肝機能障害、黄疸
(頻度不明)
劇症肝炎、肝機能障害、黄疸(初期症状:嘔気・嘔吐、食欲不振、倦怠感、そう痒等)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
汎血球減少症、無顆粒球症、溶血性貧血、血小板減少
(頻度不明)
汎血球減少症、無顆粒球症(初期症状:発熱、咽頭痛、倦怠感等)、ヘモグロビン尿等を伴う溶血性貧血、血小板減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
間質性肺炎、好酸球性肺炎
(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、好酸球性肺炎があらわれることがあるので、このような症状が認められた場合には投与を中止し、副腎皮質ホルモン剤投与等の適切な処置を行うこと。
偽膜性大腸炎等の血便を伴う重篤な大腸炎
(頻度不明)
偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがあるので、腹痛、頻回の下痢等が認められた場合には投与を中止し、適切な処置を行うこと。
横紋筋融解症
(頻度不明)
筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇等を特徴とし、急激な腎機能悪化を伴う横紋筋融解症があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
低血糖
(頻度不明)
低血糖があらわれることがあり、低血糖性昏睡に至る例も報告されているので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。糖尿病患者(特にスルホニルウレア系薬剤やインスリン製剤等を投与している患者)、腎機能障害患者、高齢者であらわれやすい。
**アキレス腱炎、腱断裂等の腱障害
(頻度不明)
アキレス腱炎、腱断裂等の腱障害があらわれることがあるので、腱周辺の痛み、浮腫、発赤等の症状が認められた場合には投与を中止し、適切な処置を行うこと。臓器移植の既往のある患者であらわれやすい。
錯乱、せん妄、抑うつ等の精神症状
(頻度不明)
錯乱、せん妄、抑うつ等の精神症状があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
過敏性血管炎
(頻度不明)
過敏性血管炎があらわれることがあるので、発熱、腹痛、関節痛、紫斑、斑状丘疹や、皮膚生検で白血球破砕性血管炎等の症状が認められた場合には投与を中止し、適切な処置を行うこと。
重症筋無力症の悪化
(頻度不明)
重症筋無力症の患者で症状の悪化があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
*大動脈瘤、大動脈解離
(頻度不明)
大動脈瘤、大動脈解離を引き起こすことがあるので、異常が認められた場合には適切な処置を行うこと(「慎重投与」、「重要な基本的注意」の項参照)。
**末梢神経障害
(頻度不明)
末梢神経障害があらわれることがあるので、しびれ、筋力低下、痛み等の症状が認められた場合には投与を中止し、適切な処置を行うこと。