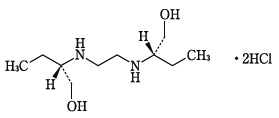
エタンブトール製剤
1錠 12.7円
| 色・剤形(又は性状) | 黄色のフィルムコーティング錠 |
|---|---|
| 外形・表 |  |
| 外形・裏 |  |
| 外形・側面 |  |
| 大きさ・直径 | 8.7mm |
| 大きさ・厚さ | 4.1mm |
| 質量 | 209mg |
| 識別コード(PTP) | E125 |
| 色・剤形(又は性状) | 黄色のフィルムコーティング錠 |
|---|---|
| 外形・表 |  |
| 外形・裏 |  |
| 外形・側面 |  |
| 大きさ・直径 | 10.5mm |
| 大きさ・厚さ | 5.5mm |
| 質量 | 418mg |
| 識別コード(PTP) | E250 |
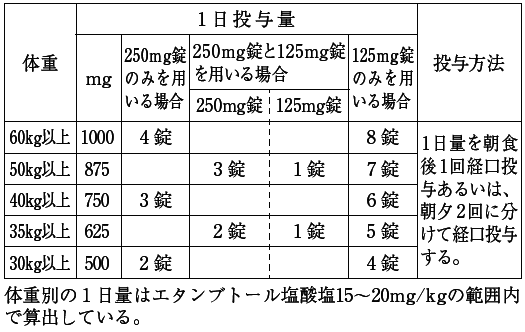
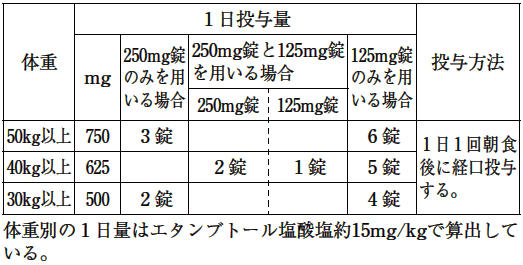
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| リファンピシン | 視力障害が増強されるおそれがある。 | 機序は不明であるが、動物実験(ラット)において、併用した場合に本剤の視力障害を増強したとの報告がある。 |
| 他の抗結核薬 イソニアジド リファンピシン等 | 重篤な肝障害があらわれることがあるので、定期的に肝機能検査を行うこと。 | 機序不明 |