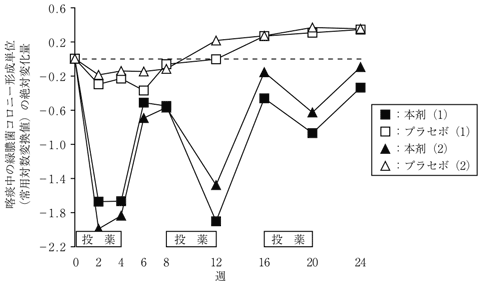
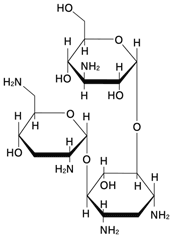
1
Geller DE,et al.:Pediatr Pulmonol. 2007;42(4):307-313
2
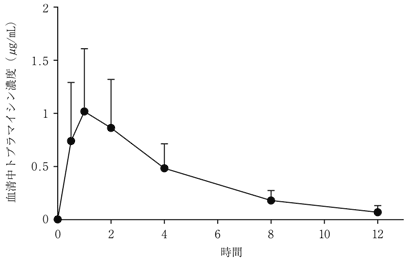
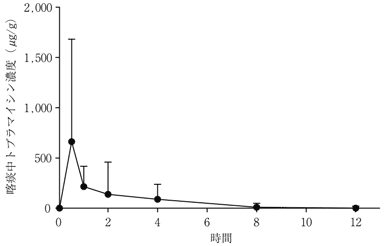
社内資料:外国人嚢胞性線維症患者を対象とした単回投与試験(承認年月日:2012.9.28、CTD2.7.2.2.1.1)
3
Geller DE,et al.:Chest. 2002;122(1):219-226
4
Gordon RC,et al.:Antimicrob Agents Chemother. 1972;2(3):214-216
5
石山俊次ほか:Chemotherapy. 1975;23(3):1151-1168
6
Neu HC.:J Infect Dis. 1976;134(Suppl.):S3-S19
7
山作房之輔ほか:Jpn J Antibiot. 1981;34(11):1429-1435
8
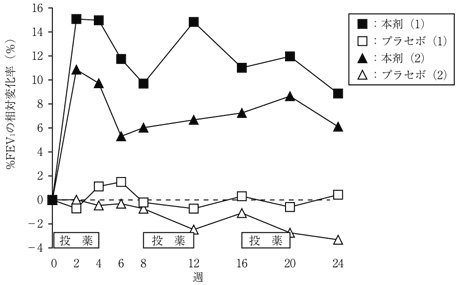
社内資料:外国人嚢胞性線維症患者を対象とした第Ⅲ相試験(承認年月日:2012.9.28、CTD2.7.6.4.1.1)
9
社内資料:外国人嚢胞性線維症患者を対象とした第Ⅲ相試験(承認年月日:2012.9.28、CTD2.7.6.4.1.2)
10
Trevor AJ,et al.:ガッツング・コア薬理学. 丸善株式会社. 2006;原書7版:383-385