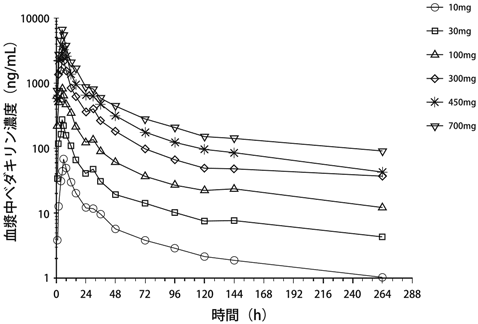
1
Court R, et al.:Br J Clin Pharmacol. 2022;88(8):3548-3558
2
社内資料:ラット出生前及び出生後の発生並びに母体の機能に関する試験(TMC207-TOX9296)(2018年1月19日承認、CTD 2.6.6.6.8)
3
社内資料:マウス13週間反復強制経口投与毒性試験(TMC207-TOX7419)(2018年1月19日承認、CTD 2.6.6.3.3)
4
社内資料:ラット1ヵ月間反復強制経口投与毒性試験(TMC207-TOX6017)(2018年1月19日承認、CTD 2.6.6.3.6)
5
社内資料:ラット26週間反復強制経口投与毒性試験(TMC207-TOX7421)(2018年1月19日承認、CTD 2.6.6.3.8)
6
社内資料:イヌ1ヵ月間反復強制経口投与毒性試験(TMC207-TOX6018)(2018年1月19日承認、CTD 2.6.6.3.10)
7
社内資料:イヌ26週間反復強制経口投与毒性試験(TMC207-TOX6612)(2018年1月19日承認、CTD 2.6.6.3.11)
8
社内資料:イヌ39週間反復強制経口投与毒性試験(TMC207-TOX9239)(2018年1月19日承認、CTD 2.6.6.3.13)
9
社内資料:TMC207の健康成人被験者に対する臨床成績(R207910-CDE-101)(2018年1月19日承認、CTD 2.7.2.2.2.1)
10
社内資料:TMC207の健康成人被験者に対する臨床成績(R207910-CDE-102)(2018年1月19日承認、CTD 2.7.2.2.2.1)
11
社内資料:TMC207の多剤耐性肺結核を有する日本人患者に対する臨床成績(TMC207-TBC2001)(2018年1月19日承認、CTD 2.7.2.2.2.3)
12
社内資料:TMC207の多剤耐性肺結核を有する外国人患者に対する臨床成績(TMC207-C208 stage2)(2018年1月19日承認、CTD 2.7.2.2.2.2)
13
社内資料:TMC207の健康成人被験者に対する臨床成績(TMC207-C108)(2018年1月19日承認、CTD 2.7.1.2.1.1)
14
社内資料:TMC207の肝機能障害患者に対する臨床成績(TMC207-C112)(2018年1月19日承認、CTD 2.7.2.2.2.4)
15
社内資料:TMC207の母集団薬物動態解析に関する検討(TMC207-201105)(2018年1月19日承認、CTD 2.7.2.3.1.6)
16
社内資料:TMC207の健康成人被験者に対する薬物相互作用の検討(TMC207-BAC1003)(2018年1月19日承認、CTD 2.7.2.2.2.5)
17
社内資料:TMC207の健康成人被験者に対する薬物相互作用の検討(TMC207-C104)(2018年1月19日承認、CTD 2.7.2.2.2.5)
18
社内資料:TMC207の健康成人被験者に対する薬物相互作用の検討(TMC207-C109)(2018年1月19日承認、CTD 2.7.2.2.2.5)
19
社内資料:TMC207の健康成人被験者に対する薬物相互作用の検討(TMC207-C110)(2018年1月19日承認、CTD 2.7.2.2.2.5)
20
社内資料:TMC207の健康成人被験者に対する薬物相互作用の検討(TMC207-C117)(2018年1月19日承認、CTD 2.7.2.2.2.5)
21
Diacon AH, et al.:N EnglJ Med. 2014;371(8):723-732
22
Pym AS, et al.:Eur Respir J. 2016;47(2):564-574
23
社内資料:TMC207の健康成人被験者のQT延長に関する臨床成績(TMC207-TBC1003)(2018年1月19日承認、CTD 2.7.2.2.3)
24
Koul A, et al.:Nat Commun. 2014;5:3369
25
社内資料:TMC207の抗菌活性の検討(TMC207-TiDP13-C209)(2018年1月19日承認、CTD 2.7.2.4.2.1)
26
Andries K, et al.:Science. 2005;307(5707):223-227
27
Huitric E, et al.:Antimicrob Agents Chemother. 2010;54(3):1022-1028
28
社内資料:TMC207の耐性機序(TMC207-Resistance Mechanisms-ABMR)(2018年1月19日承認、CTD 2.7.2.4.2.7)