1
大石紫満子, 他:薬理と治療. 1998;26(8):1253-1266
2
海外および国内で実施された臨床薬理試験(体内動態)の比較(リピトール錠:2000年3月10日承認、申請資料概要 ヘ.3.(5).1))
3
大石紫満子, 他:薬理と治療. 1998;26(8):1279-1293
4
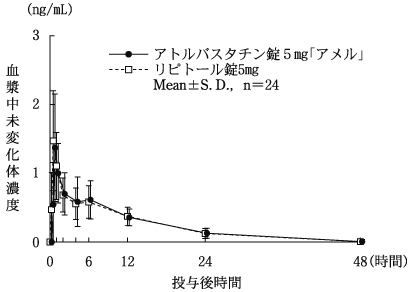
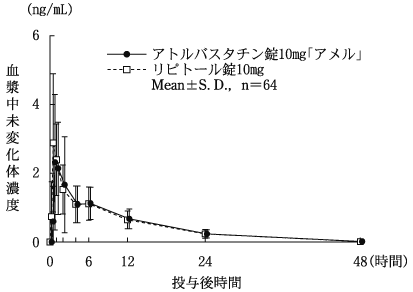
社内資料:生物学的同等性試験[錠5mg、錠10mg]
5
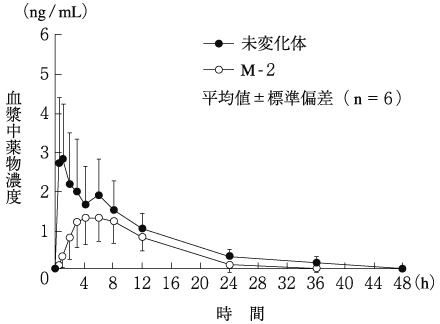
大石紫満子, 他:薬理と治療. 1998;26(8):1267-1277
6
根本裕之, 他:薬理と治療. 1998;26(8):1229-1240
7
代謝酵素(リピトール錠:2000年3月10日承認、申請資料概要 ヘ.3.(7).4))
8
排泄(リピトール錠:2000年3月10日承認、申請資料概要 ヘ.3.(8))
9
代謝(リピトール錠:2000年3月10日承認、申請資料概要 ヘ.3.(7))
10
血漿蛋白結合率、代謝、排泄(カデュエット配合錠1番・2番・3番・4番:2009年7月7日承認、申請資料概要 2.5.3.(2))
11
Stern, R. H. et al.:J. Clin. Pharmacol. 1997;37(9):816-819
12
肝機能障害例における検討(リピトール錠:2000年3月10日承認、申請資料概要 ヘ.3.(6).5))
13
大石紫満子, 他:薬理と治療. 1998;26(8):1295-1305
14
中村治雄, 他:Prog. Med. 1998;18(7):1690-1723
15
後期第Ⅱ相試験(用量設定試験)(リピトール錠:2000年3月10日承認、申請資料概要 ト.1.(3))
16
山村卓, 他:臨床医薬. 1998;14(11):2031-2054
17
家族性高コレステロール血症ヘテロ接合体患者対象試験(リピトール錠:2000年3月10日承認、申請資料概要 ト.1.(7).1))
18
家族性高コレステロール血症ホモ接合体患者に対する試験(リピトール錠:2000年3月10日承認、申請資料概要 ト.1.(7).2))
19
田妻進, 他:臨床医薬. 1998;14(12):2163-2177
20
血液凝固・線溶系に及ぼす影響の検討試験(リピトール錠:2000年3月10日承認、申請資料概要 ト.1.(8).2))
21
田中明, 他:新薬と臨床. 1998;47(8):1230-1248
22
作用機序(リピトール錠:2000年3月10日承認、申請資料概要 ホ.1.8)
23
舩津敏之, 他:薬理と治療. 1998;26(9):1435-1441
24
田中秀行, 他:薬理と治療. 1998;26(9):1451-1454
25
Bocan, T. M. et al.:Atherosclerosis. 1994;111(1):127-142
26
Burnett, J. R. et al.:Arterioscler. Thromb. Vasc. Biol. 1997;17(11):2589-2600
27
Bisgaier, C. L. et al.:J. Lipid. Res. 1997;38(12):2502-2515
28
荒井幸規, 他:薬理と治療. 1998;26(9):1475-1481,1483-1486
29
鈴木雅徳, 他:薬理と治療. 1998;26(9):1469-1474
30
代謝物の薬理作用(リピトール錠:2000年3月10日承認、申請資料概要 ホ.1.7)
31
舩津敏之, 他:薬理と治療. 1998;26(9):1443-1450
32
Funatsu, T. et al.:Atherosclerosis. 2001;157(1):107-115
33
角田裕俊, 他:薬理と治療. 1998;26(9):1461-1468










 0120-041-189
0120-041-189

