1
Wan SH, et al.: J Pharm Sci. 1974; 63(5): 708-711
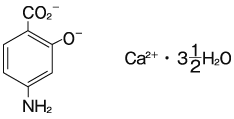
2
熊谷 洋, 他: 臨床薬理学大系. 1964; 10: 56-65
抗結核剤
1g 30.5円
有効成分 | (1g中)日局 パラアミノサリチル酸カルシウム水和物 1g |
|---|
| 性状・剤形 | 白色~灰褐色・顆粒剤 |
|---|
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
経口抗凝血剤 ワルファリン | 抗凝血作用が増強することがある。 異常が認められた場合には、抗凝血剤を減量するなど適切な処置を行う。 | 本剤は肝のプロトロンビン形成抑制作用がある。また、ワルファリンの血中濃度を上昇させる。 |
フェニトイン | フェニトインの血中濃度が上昇し、作用が増強することがある。 異常が認められた場合には、フェニトインを減量するなど適切な処置を行う。 | フェニトインの代謝酵素(チトクロームP450)を阻害する。 |
頻度不明 | |
|---|---|
過敏症 | 発熱、皮膚症状 |
血液 | 白血球減少、血小板減少 |
甲状腺 | 甲状腺機能障害又は甲状腺腫 |
肝臓 | AST、ALTの上昇 |
腎臓 | 蛋白尿 |
消化器 | 食欲不振、悪心、胃部不快感、下痢 |