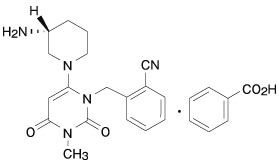
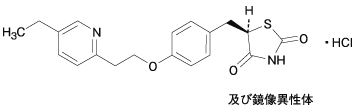
1
前芝良宏 他:薬理と治療.1996;24:2597-2617.
2
Lewis JD, et al.:JAMA.2015;314:265-277.
3
Korhonen P, et al.:BMJ.2016;354:i3903.
4
Azoulay L, et al.:BMJ.2012;344:e3645.
5
Hsiao FY, et al.:Drug Safety.2013;36:643-649.
6
Saez E, et al.:Nature Medicine.1998;4:1058-1061.
7
Lefebvre A-M, et al.:Nature Medicine.1998;4:1053-1057.
8
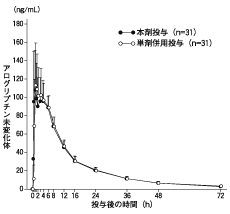
アログリプチン/ピオグリタゾン配合剤の生物学的同等性試験成績(2011年7月1日承認:CTD 2.7.6.1)
9
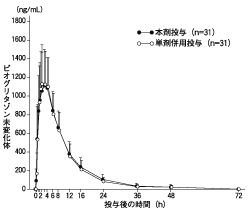
アログリプチン/ピオグリタゾン配合剤の薬物動態試験成績(2011年7月1日承認:CTD 2.7.6.1)
10
アログリプチンの蛋白結合に関する検討(2010年4月16日承認:CTD2.7.2.2)
11
ピオグリタゾンの蛋白結合に関する検討(1999年9月22日承認:申請資料概要ヘ2.2.(4))
12
アログリプチンの代謝に関する検討①(2010年4月16日承認:CTD2.7.2.1)
13
アログリプチンの代謝に関する検討②(2010年4月16日承認:CTD2.7.2.2)
14
アログリプチンの代謝に関する検討③(2010年4月16日承認:CTD2.7.2.3)
15
ピオグリタゾンの代謝に関する検討①(1999年9月22日承認:申請資料概要ヘ2.3.(1))
16
ピオグリタゾンの代謝に関する検討②(1999年9月22日承認:申請資料概要ヘ2.5.(3))
17
アログリプチンの薬物動態試験成績①(2010年4月16日承認:CTD2.7.6.7)
18
アログリプチンの薬物動態試験成績②(2010年4月16日承認:CTD2.7.6.6)
19
アログリプチンの薬物動態試験成績③(2010年4月16日承認:CTD2.7.2.2)
20
ピオグリタゾンの薬物動態試験成績(1999年9月22日承認:申請資料概要ヘ4)
21
アログリプチンの腎機能障害者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.14)
22
アログリプチンの肝機能障害者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.15)
23
アログリプチンの高齢者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.13)
24
アログリプチンとピオグリタゾンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
25
アログリプチンとボグリボースとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
26
アログリプチンとアトルバスタチンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
27
アログリプチンとフルコナゾール、ケトコナゾール又はゲムフィブロジルとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
28
アログリプチンとシクロスポリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
29
アログリプチンとカフェイン、トルブタミド、デキストロメトルファン、ミダゾラム又はフェキソフェナジンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
30
アログリプチンとワルファリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
31
アログリプチンとエチニルエストラジオール及びノルエチンドロンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
32
アログリプチンとジゴキシンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
33
アログリプチンとグリベンクラミドとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.6.21)
34
アログリプチンとメトホルミン、シメチジンとの薬物間相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
35
ピオグリタゾンとグリベンクラミド、グリクラジドとの薬物間相互作用試験成績(1999年9月22日承認:申請資料概要ト1.(3))
36
社内資料:ピオグリタゾンとメトホルミンとの薬物間相互作用試験
37
ピオグリタゾンとボグリボースとの薬物間相互作用試験成績(1999年9月22日承認:申請資料概要ト1.(6))
38
アログリプチン/ピオグリタゾン配合剤の臨床試験成績①(2011年7月1日承認:CTD 2.7.6.2)
39
アログリプチン/ピオグリタゾン配合剤の臨床試験成績②(2011年7月1日承認:CTD 2.7.6.3)
40
社内資料:アログリプチンにピオグリタゾン又はプラセボを併用投与した製造販売後臨床試験成績
41
アログリプチンの耐糖能改善作用に関する検討①(2010年4月16日承認:CTD2.4.2)
42
アログリプチンの耐糖能改善作用に関する検討②(2010年4月16日承認:CTD2.6.2)
43
ピオグリタゾンのインスリン抵抗性改善作用に関する検討①(1999年9月22日承認:申請資料概要イ1.(2))
44
ピオグリタゾンのインスリン抵抗性改善作用に関する検討②(1999年9月22日承認:申請資料概要イ2.(1))
45
アログリプチンの酵素阻害活性に関する検討(2010年4月16日承認:CTD2.6.2.1)
46
アログリプチンの薬物動態試験成績④(2010年4月16日承認:CTD2.7.6.27)
47
アログリプチンの耐糖能改善作用に関する検討③(2010年4月16日承認:CTD2.6.2.2)
48
アログリプチン/ピオグリタゾン配合剤の薬理試験成績①(2011年7月1日承認:CTD 2.6.2.1)
49
アログリプチン/ピオグリタゾン配合剤の薬理試験成績②(2011年7月1日承認:CTD 2.6.2.2)
50
ピオグリタゾンのインスリン抵抗性改善作用に関する検討③(1999年9月22日承認:申請資料概要ホ1.(1))
51
ピオグリタゾンのインスリン抵抗性改善作用に関する検討④(1999年9月22日承認:申請資料概要ホ1.(1))
52
ピオグリタゾンのインスリン抵抗性改善作用に関する検討⑤(1999年9月22日承認:申請資料概要ホ1.(1))
53
ピオグリタゾンのインスリン抵抗性改善作用に関する検討⑥(1999年9月22日承認:申請資料概要ホ1.(2))
54
ピオグリタゾンの末梢組織におけるインスリン作用増強に関する検討(1999年9月22日承認:申請資料概要ホ1.(2))
55
ピオグリタゾンの肝におけるインスリン作用増強に関する検討(1999年9月22日承認:申請資料概要ホ1.(2))
56
ピオグリタゾンのインスリン受容体作用増強に関する検討(1999年9月22日承認:申請資料概要ホ1.(2))
57
ピオグリタゾンのTNF-α産生抑制作用に関する検討(1999年9月22日承認:申請資料概要ホ1.(2))
58
ピオグリタゾンの糖代謝改善作用に関する検討①(1999年9月22日承認:申請資料概要ホ1.(1))
59
ピオグリタゾンの糖代謝改善作用に関する検討②(1999年9月22日承認:申請資料概要ホ1.(1))
60
ピオグリタゾンの耐糖能改善作用に関する検討①(1999年9月22日承認:申請資料概要ホ1.(1))
61
ピオグリタゾンの耐糖能改善作用に関する検討②(1999年9月22日承認:申請資料概要ホ1.(1))





 382
382
 383
383