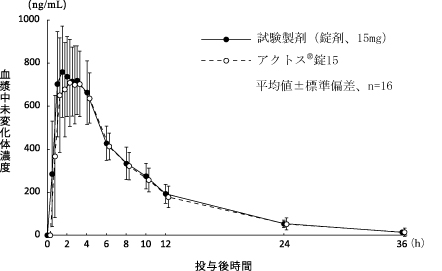
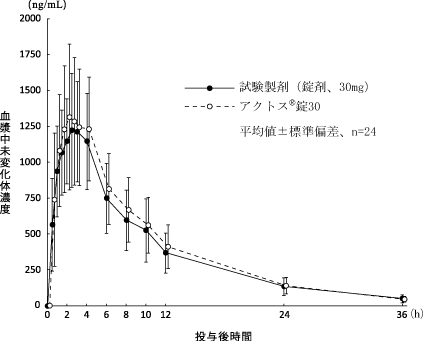
1
前芝良宏 他:薬理と治療. 1996;24(12):2597-2617
2
Lewis, J. D. et al.:JAMA. 2015;314(3):265-277
3
Korhonen, P. et al.:BMJ. 2016;354:i3903
4
Azoulay, L. et al.:BMJ. 2012;344:e3645
5
Hsiao, F. Y. et al.:Drug Saf. 2013;36(8):643-649
6
Saez, E. et al.:Nat. Med. 1998;4(9):1058-1061
7
Lefebvre, A. M. et al.:Nat. Med. 1998;4(9):1053-1057
8
平賀興吾:臨牀と研究. 1997;74(5):1184-1201
9
東 純一 他:臨牀と研究. 1997;74(6):1627-1637
10
持田製薬販売社内資料:ピオグリタゾン錠「モチダ」の生物学的同等性試験
11
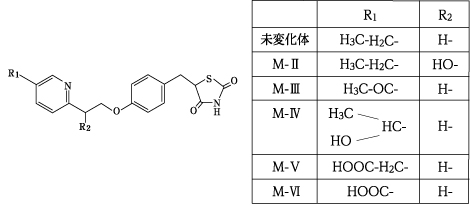
代謝に関与するヒトシトクロームP450の同定(アクトス錠:1999年9月22日承認、申請資料概要 へ.2.3(2))
12
AD-4833のヒトCYPに対する作用(アクトス錠:1999年9月22日承認、申請資料概要 へ.2.5(3))
13
播 穣治 他:臨牀と研究. 1997;74(5):1217-1226
14
兼子俊男 他:臨牀と研究. 1997;74(6):1540-1556
15
日本人の健康成人男子を対象とした薬物相互作用試験(アクトス錠:2008年12月22日承認、審査報告書、審査報告(1)Ⅱ.4(ⅱ)(1))
16
兼子俊男 他:臨牀と研究. 1997;74(5):1250-1277
17
兼子俊男 他:臨牀と研究. 1997;74(5):1278-1306
18
兼子俊男 他:臨牀と研究. 1997;74(6):1491-1514
19
兼子俊男 他:臨牀と研究. 1997;74(6):1515-1539
20
高科成良 他:臨牀と研究. 1997;74(6):1614-1626
21
兼子俊男 他:臨牀と研究. 1997;74(6):1557-1588
22
兼子俊男 他:臨牀と研究. 1997;74(6):1589-1613
23
食事療法のみのNIDDMを対象とした試験(アクトス錠:1999年9月22日承認、申請資料概要 ト.1.(5)1))
24
SU剤使用中のNIDDMを対象とした試験(アクトス錠:1999年9月22日承認、申請資料概要 ト.1.(5)2))
25
第Ⅲ相二重盲検比較試験(アクトス錠:2002年6月17日承認、審査報告書、審査報告(1)2.ト.)
26
繁田幸男 他:医学のあゆみ. 2003;206(4):297-319
27
国内第Ⅲ相試験(アクトス錠:2008年12月22日承認、審査報告書、審査報告(1)Ⅱ.4(ⅲ)(2))
28
国内第Ⅲ相二重盲検比較試験(アクトス錠:2009年3月24日承認、審査報告書、審査報告(1)Ⅱ.4(ⅲ)(1))
29
効力を裏付ける試験(アクトス錠:1999年9月22日承認、申請資料概要 ホ.1.)
30
Sugiyama, Y. et al.:Arzneim.-Forsch./Drug Res. 1990;40(3):263-267
31
Sugiyama, Y. et al.:Arzneim.-Forsch./Drug Res. 1990;40(4):436-440
32
Hayakawa, T. et al.:Biochem. Biophys. Res. Commun. 1996;223(2):439-444
33
Murase, K. et al.:Diabetologia. 1998;41(3):257-264
34
池田 衡 他:薬理と治療. 1997;25(2):337-343
35
Kawamori, R. et al.:Diabetes Res. Clin. Pract. 1998;41(1):35-43
36
Yamasaki, Y. et al.:Tohoku J. Exp. Med. 1997;183(3):173-183
37
グルコース・クランプ法を用いたインスリン感受性に及ぼす効果の検討(アクトス錠:1999年9月22日承認、申請資料概要 ト.1.(7)1))