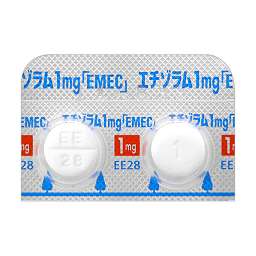
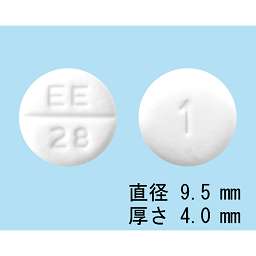
1
第十八改正 日本薬局方解説書 廣川書店. 2021:C-904-907
2
第十八改正日本薬局方医薬品情報JPDI2021,123-124
3
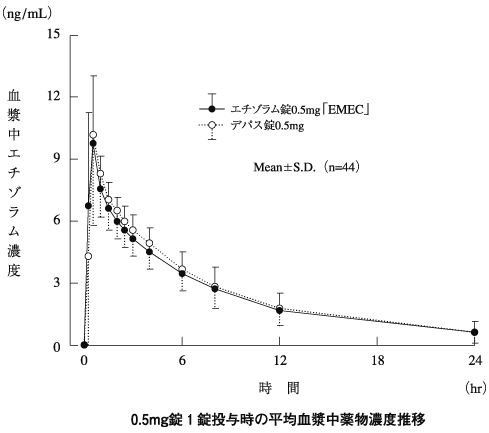
社内資料:生物学的同等性試験
4
Kato, Y. et al.: Arzneimittel Forschung. 1978; 28(7): 1170-1173
5
Itil, T. M. et al.: Psychopharmacol Bull. 1982; 18(4): 165-172
6
斎藤正己 他: 脳波と筋電図. 1976; 4(1): 27-40
7
Nakazawa, Y. et al.: Psychopharmacologia. 1975; 44(2): 165-171