1
前芝良宏 他:薬理と治療. 1996;24:2597-2617
2
Lewis J.D. et al.:JAMA. 2015;314:265-277
3
Korhonen P. et al.:BMJ. 2016;354:i3903
4
Azoulay L. et al.:BMJ. 2012;344:e3645
5
Hsiao F.Y. et al.:Drug Safety. 2013;36:643-649
6
Saez E. et al.:Nature Medicine. 1998;4:1058-1061
7
Lefebvre A.M. et al.:Nature Medicine. 1998;4:1053-1057
8
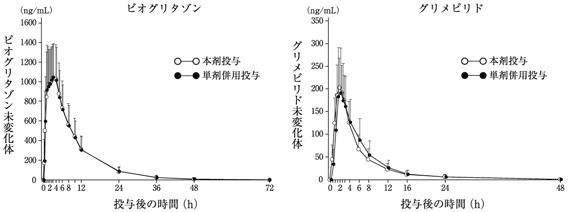
社内資料:ピオグリタゾン/グリメピリド配合剤薬物動態試験成績①
9
社内資料:ピオグリタゾン/グリメピリド配合剤薬物動態試験成績②
10
社内資料:ピオグリタゾンのヒトP450分子種発現系ミクロゾームによる代謝に関する試験
11
社内資料:ピオグリタゾンのチトクロームP450(CYP)に対する影響に関する試験
12
Niemi M. et al.:Clin.Pharmacol.Ther. 2002;72:326-332
13
Yamazaki H. et al.:Arzneimittelforschung. 1993;43:1317-1321
14
東 純一 他:臨牀と研究. 1997;74:1627-1637
15
中島光好 他:臨床医薬. 1993;9:503-522
16
社内資料:ピオグリタゾン/グリメピリド配合剤臨床試験成績
17
池田 衡 他:薬理と治療. 1997;25:337-343
18
Sugiyama Y. et al.:Arzneimittelforschung. 1990;40:263-267
19
Sugiyama Y. et al.:Arzneimittelforschung. 1990;40:436-440
20
Hayakawa T. et al.:Biochem.Biophys.Res.Commun. 1996;223:439-444
21
Murase K. et al.:Diabetologia. 1998;41:257-264
22
兼子俊男 他:臨牀と研究. 1997;74:1515-1539
23
中島光好 他:臨床医薬. 1993;9:535-548
24
Geisen K.:Arzneimittelforschung. 1988;38:1120-1130
25
久保田昌詞 他:糖尿病. 1995;38:447-453
26
久保田昌詞 他:糖尿病. 1992;35(Suppl.1):204
27
Müller G. et al.:Diabetes Res.Clin.Pract. 1995;28:S115-S137
28
Müller G. et al.:Diabetes. 1993;42:1852-1867





 323
323
 324
324