作成又は改訂年月
**
2020年9月改訂
(第7版)
*2020年1月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
ゲンタマイシン硫酸塩注射液10mg「日医工」
販売名コード
承認・許可番号
22200AMX00677000
Gentamicin Sulfate
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存
使用期限:
外箱等に表示の使用期限内に使用すること
基準名
規制区分
劇薬
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1管中
ゲンタマイシン硫酸塩
10mg(力価)/1mL
添加物
1管中
ベンジルアルコール15mg,乾燥亜硫酸ナトリウム0.3mg,ピロ亜硫酸ナトリウム1.7mg
製剤の性状
| 剤形・性状 | 水性の注射剤
無色澄明の液 |
|---|
| pH | 4.0〜6.0 |
|---|
| 浸透圧比(生理食塩液に対する比) | 0.6〜0.9 |
|---|
販売名
ゲンタマイシン硫酸塩注射液40mg「日医工」
販売名コード
承認・許可番号
22300AMX01195000
Gentamicin Sulfate
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存
使用期限:
外箱等に表示の使用期限内に使用すること
基準名
規制区分
劇薬
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1管中
ゲンタマイシン硫酸塩
40mg(力価)/1mL
添加物
1管中
ベンジルアルコール15mg,乾燥亜硫酸ナトリウム0.5mg,ピロ亜硫酸ナトリウム1.5mg
製剤の性状
| 剤形・性状 | 水性の注射剤
無色澄明の液 |
|---|
| pH | 4.0〜6.0 |
|---|
| 浸透圧比(生理食塩液に対する比) | 0.8〜1.2 |
|---|
販売名
ゲンタマイシン硫酸塩注射液60mg「日医工」
販売名コード
承認・許可番号
22300AMX01196000
Gentamicin Sulfate
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存
使用期限:
外箱等に表示の使用期限内に使用すること
基準名
規制区分
劇薬
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1管中
ゲンタマイシン硫酸塩
60mg(力価)/1.5mL
添加物
1管中
ベンジルアルコール22.5mg,乾燥亜硫酸ナトリウム0.75mg,ピロ亜硫酸ナトリウム2.25mg
製剤の性状
| 剤形・性状 | 水性の注射剤
無色澄明の液 |
|---|
| pH | 4.0〜6.0 |
|---|
| 浸透圧比(生理食塩液に対する比) | 0.8〜1.2 |
|---|
禁忌
本剤の成分並びに他のアミノグリコシド系抗生物質及びバシトラシンに対し過敏症の既往歴のある患者
原則禁忌
本人又はその血族がアミノグリコシド系抗生物質による難聴又はその他の難聴のある患者[難聴が発現又は増悪するおそれがある。]
効能又は効果
効能又は効果に関連する使用上の注意
**中耳炎への使用にあたっては,「抗微生物薬適正使用の手引き」1)を参照し,抗菌薬投与の必要性を判断した上で,本剤の投与が適切と判断される場合に投与すること。
<適応菌種>
ゲンタマイシンに感性のブドウ球菌属,大腸菌,クレブシエラ属,エンテロバクター属,セラチア属,プロテウス属,モルガネラ・モルガニー,プロビデンシア属,緑膿菌
<適応症>
敗血症,外傷・熱傷及び手術創等の二次感染,肺炎,膀胱炎,腎盂腎炎,腹膜炎,中耳炎
用法及び用量
通常,成人ではゲンタマイシン硫酸塩として1日3mg(力価)/kgを3回に分割して筋肉内注射または点滴静注する。増量する場合は,1日5mg(力価)/kgを限度とし,3〜4回に分割して投与する。
小児では,1回2.0〜2.5mg(力価)/kgを1日2〜3回筋肉内注射または点滴静注する。
点滴静注においては30分〜2時間かけて注入する。
なお,年齢,症状により適宜減量する。
用法及び用量に関連する使用上の注意
本剤の使用にあたっては,耐性菌の発現等を防ぐため,原則として感受性を確認し,疾病の治療上必要な最小限の期間の投与にとどめること。
腎障害のある患者には,投与量を減ずるか,投与間隔をあけて使用すること。(「慎重投与」の項参照)
成人に1日最大5mg(力価)/kgまで増量した場合,副作用の発現を防ぐため,臨床的改善が認められた場合は,速やかに減量すること。
使用上の注意
慎重投与
腎障害のある患者[高い血中濃度が持続し,腎障害が悪化するおそれがあり,また,第8脳神経障害等の副作用が強くあらわれるおそれがある。]
肝障害のある患者[肝障害を悪化させるおそれがある。]
重症筋無力症の患者[神経筋遮断作用がある。]
高齢者(「高齢者への投与」の項参照)
経口摂取の不良な患者又は非経口栄養の患者,全身状態の悪い患者[ビタミンK欠乏症状があらわれることがあるので観察を十分に行うこと。]
低出生体重児,新生児(「小児等への投与」の項参照)
重要な基本的注意
本剤によるショック,アナフィラキシーの発生を確実に予知できる方法がないので,次の措置をとること。
事前に既往歴等について十分な問診を行うこと。なお,抗生物質等によるアレルギー歴は必ず確認すること。
投与に際しては,必ずショック等に対する救急処置のとれる準備をしておくこと。
投与開始から投与終了後まで,患者を安静の状態に保たせ,十分な観察を行うこと。特に,投与開始直後は注意深く観察すること。
眩暈,耳鳴,難聴等の第8脳神経障害があらわれることがあるので慎重に投与すること。特に腎機能障害患者,高齢者,長期間投与患者及び大量投与患者等では血中濃度が高くなりやすく,聴力障害の危険性がより大きくなるので,聴力検査を実施することが望ましい。アミノグリコシド系抗生物質の聴力障害は,高周波音に始まり低周波音へと波及するので,障害の早期発見のために,聴力検査の最高周波数である8kHzでの検査が有用である。
急性腎障害等の重篤な腎障害があらわれることがあるので慎重に投与すること。
投与期間中は血中濃度をモニタリングすることが望ましい。特に,腎機能障害患者,低出生体重児,新生児,高齢者,長期間投与患者及び大量投与患者等では血中濃度が高くなりやすいので,注意すること。(「高齢者への投与」,「小児等への投与」の項参照)
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
腎障害を起こすおそれのある血液代用剤
デキストラン,
ヒドロキシエチルデンプン等 | 腎障害が発現,悪化することがあるので,併用は避けることが望ましい。
腎障害が発生した場合には,投与を中止し,透析療法等適切な処置を行うこと。 | 機序は明確ではないが,併用によりアミノグリコシド系抗生物質の血中濃度の上昇,近位尿細管上皮の空胞変性が生じるという報告がある。 |
ループ利尿剤
エタクリン酸,
アゾセミド,
フロセミド等 | 腎障害及び聴器障害が発現,悪化するおそれがあるので,併用は避けることが望ましい。 | 機序は明確ではないが,併用によりアミノグリコシド系抗生物質の血中濃度の上昇,腎への蓄積が起こるという報告がある。 |
腎毒性及び聴器毒性を有する薬剤
バンコマイシン塩酸塩,
エンビオマイシン硫酸塩,
白金含有抗悪性腫瘍剤(シスプラチン,カルボプラチン,ネダプラチン)等 | 腎障害及び聴器障害が発現,悪化するおそれがあるので,併用は避けることが望ましい。 | 両薬剤ともに腎毒性,聴器毒性を有するが相互作用の機序は不明。 |
麻酔剤,筋弛緩剤
ツボクラリン塩化物塩酸塩水和物,
パンクロニウム臭化物,
ベクロニウム臭化物,
トルペリゾン塩酸塩,
ボツリヌス毒素等
筋弛緩作用を有する薬剤
コリスチンメタンスルホン酸ナトリウム等 | 呼吸抑制があらわれるおそれがある。
呼吸抑制があらわれた場合には,必要に応じ,コリンエステラーゼ阻害剤,カルシウム製剤の投与等の適切な処置を行うこと。 | 両薬剤ともに神経筋遮断作用を有しており,併用によりその作用が増強される。 |
腎毒性を有する薬剤
シクロスポリン,
タクロリムス水和物,
アムホテリシンB,
ホスカルネットナトリウム水和物,
コリスチンメタンスルホン酸ナトリウム等 | 腎障害が発現,悪化するおそれがある。 | 両薬剤ともに腎毒性を有するが,相互作用の機序は不明。 |
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
ショック(頻度不明)
ショックを起こすことがあるので,観察を十分に行い,チアノーゼ,呼吸困難,胸内苦悶,心悸亢進,血圧低下等があらわれた場合には投与を中止し,適切な処置を行うこと。
急性腎障害(頻度不明)
急性腎障害等の重篤な腎障害があらわれることがあるので,定期的に検査を行うなど観察を十分に行い,異常が認められた場合には,投与を中止し適切な処置を行うこと。
第8脳神経障害(頻度不明)
眩暈,耳鳴,難聴等の第8脳神経障害があらわれることがあるので,観察を十分に行い,このような症状があらわれた場合には投与を中止することが望ましいが,やむを得ず投与を続ける必要がある場合には慎重に投与すること。
その他の副作用
| | 頻度不明 |
| 過敏症注1) | そう痒,発疹,発熱等 |
| 腎臓 | 浮腫,腎機能障害注1)(BUN・クレアチニン上昇,尿所見異常,乏尿等),血尿,カリウム等電解質の異常 |
| 肝臓 | ビリルビン上昇,肝機能障害注1)(AST(GOT)・ALT(GPT)・Al-Pの上昇等) |
| 神経注2) | 四肢のしびれ感,幻覚,妄想,痙攣,意識障害,頭痛 |
| 血液 | 好酸球増多,貧血,白血球減少,血小板減少 |
| 消化器 | 嘔吐,食欲不振,悪心 |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症,出血傾向等),ビタミンB群欠乏症状(舌炎,口内炎,食欲不振,神経炎等) |
| 注射部位注3) | 疼痛,硬結等 |
その他の副作用の注意
注1)異常又は症状が認められた場合には投与を中止すること。
注2)症状があらわれた場合には投与を中止することが望ましいが,やむを得ず投与を続ける必要がある場合には慎重に投与すること。
注3)筋肉内注射時
高齢者への投与
高齢者には,次の点に注意し,用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
本剤は主として腎臓から排泄されるが,高齢者では腎機能が低下していることが多いため,高い血中濃度が持続するおそれがあり,第8脳神経障害,腎障害等の副作用があらわれやすい。
高齢者では,ビタミンK欠乏による出血傾向があらわれることがある。
妊婦,産婦,授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[新生児に第8脳神経障害があらわれるおそれがある。また,動物実験(モルモット)で新生仔に外有毛細胞の消失がみられたとの報告がある。]
授乳中の婦人への投与は避けることが望ましいが,やむを得ず投与する場合は,授乳を避けさせること。[母乳中へ移行することが報告されている。]
小児等への投与
低出生体重児,新生児に対する安全性は確立していない。低出生体重児や新生児では腎の発達が未熟であるため,血中濃度の半減期が延長し,高い血中濃度が長時間持続するおそれがある。したがって,やむを得ず投与する場合には投与間隔を延長するなど慎重に投与すること。
本剤は添加物としてベンジルアルコールを含有している。外国において,低出生体重児へのベンジルアルコールの静脈内大量投与(一日平均投与量99〜234mg/kg)によりGasping症候群が発現したとの報告がある。したがって,低出生体重児に対してやむを得ず投与する場合には慎重に投与すること。
過量投与
徴候,症状
腎障害,聴覚障害,前庭障害,神経筋遮断症状,呼吸麻痺があらわれることがある。
処置
血液透析等による薬剤の除去を行う。神経筋遮断症状,呼吸麻痺に対してはコリンエステラーゼ阻害剤,カルシウム製剤の投与又は機械的呼吸補助を行う。
適用上の注意
アンプルカット時
本品はワンポイントアンプルであるが,アンプルのカット部分をエタノール綿等で清拭してからカットすることが望ましい。
調製方法
点滴静注にあたって本剤の希釈には,通常「日局」生理食塩液,5%ブドウ糖注射液を用いるが,この他に現在までに配合変化がないことが確認されている補液は,「日局」リンゲル液,20%フルクトン注,クリニット注10%,ソリタ-T3号輸液・T3号G輸液,EL-3号輸液,ラクテック注があり,これらのいずれも用いることができる。
ヘパリンナトリウムと混合すると,本剤の活性低下を来すので,それぞれ別経路で投与すること。
点滴静注時
点滴静注の場合,急速に投与しないこと。
筋肉内注射時
筋肉内注射にあたっては,組織・神経等への影響を避けるため以下の点に注意すること。
同一部位への反復注射はなるべく行わないこと。また,低出生体重児,新生児,乳児,幼児,小児には特に注意すること。
神経走行部位を避けるよう注意すること。なお,注射針を刺入したとき,神経にあたったと思われるような激痛を訴えた場合は,直ちに針を抜き,部位を変えて注射すること。
注射器の内筒を軽くひき,血液の逆流がないことを確かめて注射すること。
硬結を来すことがあるので,注射直後は局所を十分にもむこと。
その他の注意
クエン酸で抗凝固処理した血液を大量輸血された患者にアミノグリコシド系抗生物質を投与すると,投与経路にかかわらず,神経筋遮断症状,呼吸麻痺があらわれることがある。
薬物動態
生物学的同等性試験
ゲンタマイシン硫酸塩注射液10mg「日医工」及び標準製剤を,クロスオーバー法によりそれぞれ1管(ゲンタマイシン硫酸塩として10mg(力価))健康成人男子に単回筋肉内投与して血漿中ゲンタマイシン濃度を測定し,得られた薬物動態パラメータ(AUC,Cmax)について90%信頼区間法にて統計解析を行った結果,log(0.80)〜log(1.25)の範囲内であり,両剤の生物学的同等性が確認された。
2)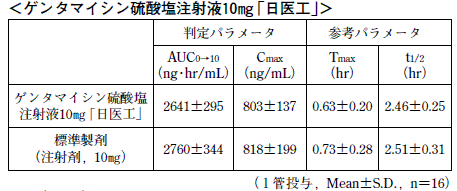
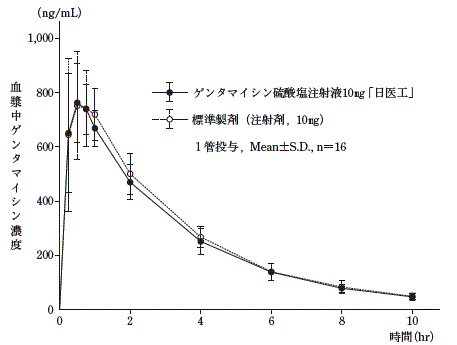
血漿中濃度並びにAUC,Cmax等のパラメータは,被験者の選択,体液の採取回数・時間等の試験条件によって異なる可能性がある。
薬効薬理
作用機序は,他のアミノグリコシド系抗生物質と同様に細菌のタンパク合成阻害であり殺菌的に作用する。黄色ブドウ球菌,緑膿菌を含むグラム陰性桿菌にすぐれた抗菌力を示し,フラジオマイシンやカナマイシンなどの,他のアミノグリコシド系抗生物質との交差耐性菌の出現頻度が低い。3)
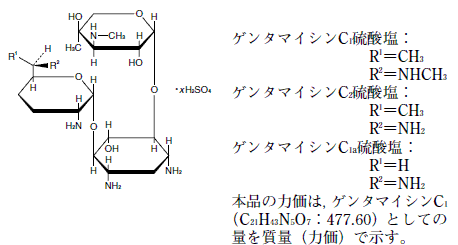
有効成分に関する理化学的知見
一般名
ゲンタマイシン硫酸塩(Gentamicin Sulfate)
略号
GM
化学名
ゲンタマイシンC1硫酸塩:
(6R )-2-Amino-2,3,4,6-tetradeoxy-6-methylamino-6-methyl-α-D-erythro -hexopyranosyl-(1→4)-[3-deoxy-4-C -methyl-3-methylamino-β-L-arabinopyranosyl-(1→6)]-2-deoxy-D-streptamine sulfate
ゲンタマイシンC2硫酸塩:
(6R )-2,6-Diamino-2,3,4,6-tetradeoxy-6-methyl-α-D-erythro -hexopyranosyl-(1→4)-[3-deoxy-4-C -methyl-3-methylamino-β-L-arabinopyranosyl-(1→6)]-2-deoxy-D-streptamine sulfate
ゲンタマイシンC1a硫酸塩:
2,6-Diamino-2,3,4,6-tetradeoxy-α-D-erythro -hexopyranosyl-(1→4)-[3-deoxy-4-C -methyl-3-methylamino-β-L-arabinopyranosyl-(1→6)]-2-deoxy-D-streptamine sulfate
構造式
性状
白色〜淡黄白色の粉末である。
水に極めて溶けやすく,エタノール(99.5)にほとんど溶けない。
吸湿性である。
取扱い上の注意
安定性試験
長期保存試験(25℃,相対湿度60%)の結果より,ゲンタマイシン硫酸塩注射液10mg「日医工」は通常の市場流通下において2年6ヵ月間安定であることが確認された。4)
長期保存試験の結果より,ゲンタマイシン硫酸塩注射液40mg「日医工」及びゲンタマイシン硫酸塩注射液60mg「日医工」は通常の市場流通下において2年6ヵ月間安定であることが確認された。4)
包装
ゲンタマイシン硫酸塩注射液10mg「日医工」
10mg(力価)/1mL×10管
ゲンタマイシン硫酸塩注射液40mg「日医工」
40mg(力価)/1mL×10管
ゲンタマイシン硫酸塩注射液60mg「日医工」
60mg(力価)/1.5mL×10管
60mg(力価)/1.5mL×50管
主要文献及び文献請求先
主要文献
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
日医工株式会社 社内資料:生物学的同等性試験
3
第十七改正日本薬局方解説書 C-1832,廣川書店,東京(2016)
4
日医工株式会社 社内資料:安定性試験
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
製造販売元
日医工株式会社
富山市総曲輪1丁目6番21