1
Yasuda,S.,et al.:Int.J.Clin.Pharmacol.Ther.,1994;32(9):466-473
2
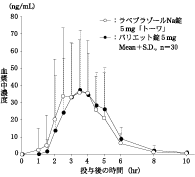
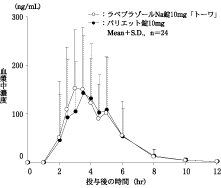
日本人健康成人男性を対象とした臨床薬理試験(2011)(パリエット錠:2014年12月26日承認、申請資料概要2.7.6.1)
3
3剤併用体内動態試験(パリエット錠、パセトシンカプセル/細粒/錠他、クラリス錠・クラリシッド錠:2007年1月26日承認、申請資料概要2.7.6.1)
4
社内資料:生物学的同等性試験(錠5mg)
5
陶易王ら:医学と薬学,2010;64(2):221-235
6
Yasuda,S.,et al.:Clin.Pharmacol.Ther.,1995;58(2):143-154
7
Ishizaki,T.,et al.:Clin.Pharmacol.Ther.,1995;58(2):155-164
8
Ishizaki,T.,et al.:Aliment.Pharmacol.Ther.,1999;13(Suppl.3):27-36
9
中澤三郎ら:Modern Physician,1994;14(S.):1-22
10
本村明ら:Modern Physician,1994;14(S.):23-37
11
中澤三郎ら:Modern Physician,1994;14(S.):38-68
12
篠村恭久ら:Modern Physician,1994;14(S.):69-84
13
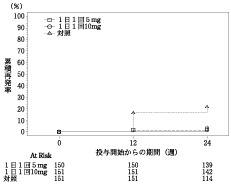
八尾恒良ら:Modern Physician,1994;14(S.):85-99
14
中川充文ら:Modern Physician,1994;14(S.):100-107
15
吉田豊ら:Modern Physician,1994;14(S.):108-115
16
中野哲ら:Modern Physician,1994;14(S.):116-123
17
谷内昭ら:Modern Physician,1994;14(S.):124-136
18
吉田豊ら:Modern Physician,1994;14(S.):137-147
19
H2受容体拮抗薬抵抗性の逆流性食道炎患者を対象とした国内第Ⅲ相試験(パリエット錠:2003年7月17日承認、申請資料概要ト.1.(2)、ト.1.(5).Ⅱ)
20
Kinoshita,Y.,et al.:Am.J.Gastroenterol.,2012;107(4):522-530
21
Kinoshita,Y.,et al.:Gastroenterol.,2018;53(7):834-844
22
プロトンポンプ阻害剤抵抗性逆流性食道炎患者を対象とした国内第Ⅲ相試験(パリエット錠:2017年9月22日承認、審査報告書)
23
Kinoshita,Y.,et al.:Aliment.Pharmacol.Ther.,2011;33(2):213-224
24
Iwakiri,R.,et al.:Aliment.Pharmacol.Ther.,2014;40(7):780-795
25
低用量アスピリン投与中かつ胃潰瘍又は十二指腸潰瘍の既往歴を有する患者を対象とした第Ⅱ/Ⅲ相試験(308試験)(パリエット錠:2014年12月26日承認、申請資料概要2.7.6.2)
26
低用量アスピリン投与中かつ308試験の24週後内視鏡検査にて潰瘍非再発が確認された患者を対象とした長期投与試験(309試験)(パリエット錠:2014年12月26日承認、申請資料概要2.7.6.3)
27
Kuwayama,H.,et al.:Aliment.Pharmacol.Ther.,2007;25(9):1105-1113
28
ヘリコバクター・ピロリ陽性の胃潰瘍または十二指腸潰瘍患者を対象とした国内第Ⅲ相試験(パリエット錠、パセトシンカプセル/細粒/錠他、クラリス錠・クラリシッド錠:2007年1月26日承認、申請資料概要2.7.6.3)
29
全有効性試験の結果の比較検討(パリエット錠、パセトシンカプセル/細粒/錠他、クラリス錠・クラリシッド錠:2007年1月26日承認、申請資料概要2.7.3.3)
30
Isomoto,H.,et al.:Aliment.Pharmacol.Ther.,2003;18(1):101-107
31
第十八改正日本薬局方解説書,2021:C-5995-C6001
32
Fujisaki,H.,et al.:Biochem.Pharmacol.,1991;42(2):321-328
33
藤崎秀明ら:日本薬理学雑誌,1993;102(6):389-397
34
岩崎有良ら:薬理と治療,1999;27(4):705-712
35
井上正規ら:内科宝函,1994;41(7):143-150
36
Fujisaki,H.,et al.:Drug Invest.,1991;3(5):328-332
37
村上学ら:G.I.Research,1993;1(5):493-496
38
河合隆ら:G.I.Research,1993;1(3):274-280
39
Morii,M.,et al.:Biochem.Pharmacol.,1990;39(4):661-667
40
村上学ら:G.I.Research,1993;1(5):497-500
41
ラットにおけるアスピリン胃潰瘍に対する作用(パリエット錠:2014年12月26日承認、申請資料概要2.6.2.2)
42
ヘリコバクター・ピロリ除菌の補助(パリエット錠、パセトシンカプセル/細粒/錠他、クラリス錠・クラリシッド錠:2007年1月26日承認、申請資料概要2.6.2.6)
43
プロトンポンプ阻害薬がヘリコバクター・ピロリ除菌に及ぼす影響(パリエット錠、パセトシンカプセル/細粒/錠他、クラリス錠・クラリシッド錠:2007年8月23日承認、審査報告書)
44
スナネズミヘリコバクター・ピロリ胃内感染モデルにおける除菌効果(パリエット錠、パセトシンカプセル/細粒/錠他、クラリス錠・クラリシッド錠:2007年1月26日承認、申請資料概要2.6.2.1)







 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

