添付文書番号
1149032F1078_1_05
企業コード
480235
作成又は改訂年月
日本標準商品分類番号
871149
薬効分類名
非ステロイド性鎮痛・抗炎症剤
承認等
販売名
エトドラク錠100mg「トーワ」
販売名コード
販売名英字表記
ETODOLAC TABLETS 100mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
規制区分
販売名
エトドラク錠200mg「トーワ」
販売名コード
販売名英字表記
ETODOLAC TABLETS 200mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
規制区分
一般的名称
エトドラク錠
禁忌(次の患者には投与しないこと)
消化性潰瘍のある患者[消化性潰瘍を悪化させることがある。]
重篤な血液の異常のある患者
重篤な肝障害のある患者
重篤な腎障害のある患者
重篤な心機能不全のある患者
重篤な高血圧症のある患者
本剤の成分に対し過敏症の既往歴のある患者
アスピリン喘息(非ステロイド性消炎鎮痛剤等による喘息発作の誘発)又はその既往歴のある患者[シクロオキシゲナーゼの活性を阻害するので、喘息を誘発することがある。]
妊娠後期の女性
組成・性状
組成
エトドラク錠100mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 エトドラク 100mg |
|---|
添加剤 | 結晶セルロース、クロスカルメロースNa、ヒドロキシプロピルセルロース、ステアリン酸Mg、ヒプロメロース、マクロゴール6000、タルク、酸化チタン、黄色三二酸化鉄、カルナウバロウ |
|---|
エトドラク錠200mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 エトドラク 200mg |
|---|
添加剤 | トウモロコシデンプン、カルメロースCa、ヒドロキシプロピルセルロース、ステアリン酸Mg、軽質無水ケイ酸、ヒプロメロース、マクロゴール6000、酸化チタン、黄色三二酸化鉄 |
|---|
製剤の性状
エトドラク錠100mg「トーワ」
| 剤形 | フィルムコーティング錠 |
|---|
| 色調 | 淡黄色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 7.1mm 大きさ(厚さ) 3.9mm |
|---|
| 質量 | 128mg |
|---|
| 識別コード | Tw332 |
|---|
エトドラク錠200mg「トーワ」
| 剤形 | フィルムコーティング錠 |
|---|
| 色調 | 淡黄色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 9.1mm 大きさ(厚さ) 4.5mm |
|---|
| 質量 | 260mg |
|---|
| 識別コード | Tw234 |
|---|
効能又は効果
用法及び用量
通常、成人にはエトドラクとして1日量400mgを朝・夕食後の2回に分けて経口投与する。
なお、年齢、症状により適宜増減する。
用法及び用量に関連する注意
他の消炎鎮痛剤との併用は避けることが望ましい。
高齢者では、少量(例えば200mg/日)から投与を開始するなど患者の状態を観察しながら慎重に投与すること。
重要な基本的注意
消炎鎮痛剤による治療は原因療法ではなく対症療法であることに留意すること。
慢性疾患(関節リウマチ、変形性関節症等)に対し本剤を用いる場合には、次の事項を考慮すること。
急性疾患に対し本剤を用いる場合には、次の事項を考慮すること。
急性炎症及び疼痛の程度を考慮し、投与すること。
原則として同一の薬剤の長期投与を避けること。
原因療法があればこれを行うこと。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
消化性潰瘍の既往歴のある患者
プロスタグランジン生合成阻害作用に基づき胃の血流量が減少するため、消化性潰瘍を再発させることがある。
非ステロイド性消炎鎮痛剤の長期投与による消化性潰瘍のある患者で、本剤の長期投与が必要であり、かつミソプロストールによる治療が行われている患者
本剤を継続投与する場合には、十分経過を観察し、慎重に投与すること。ミソプロストールは非ステロイド性消炎鎮痛剤により生じた消化性潰瘍を効能又は効果としているが、ミソプロストールによる治療に抵抗性を示す消化性潰瘍もある。
血液の異常又はその既往歴のある患者(重篤な血液の異常のある患者を除く)
白血球・赤血球・血小板減少が報告されているため、血液の異常を悪化あるいは再発させることがある。
心機能障害のある患者(重篤な心機能不全のある患者を除く)
プロスタグランジン生合成阻害作用に基づくNa・水分貯留傾向があるため、心機能障害を悪化させることがある。
高血圧症のある患者(重篤な高血圧症のある患者を除く)
プロスタグランジン生合成阻害作用に基づくNa・水分貯留傾向があるため、血圧を上昇させることがある。
気管支喘息のある患者(アスピリン喘息又はその既往歴のある患者を除く)
病態を悪化させることがある。
SLE(全身性エリテマトーデス)の患者
SLE症状(腎障害等)を悪化させることがある。
潰瘍性大腸炎の患者
病態を悪化させることがある。
クローン病の患者
病態を悪化させることがある。
感染症を合併している患者
必要に応じて適切な抗菌剤を併用し、観察を十分に行い慎重に投与すること。感染症を不顕性化するおそれがある。
腎機能障害患者
重篤な腎障害のある患者
投与しないこと。プロスタグランジン生合成阻害作用に基づく腎血流量低下作用があるため、腎障害を悪化させることがある。
腎障害又はその既往歴のある患者(重篤な腎障害のある患者を除く)
プロスタグランジン生合成阻害作用に基づく腎血流量低下作用があるため、腎障害を悪化あるいは再発させることがある。
肝機能障害患者
重篤な肝障害のある患者
投与しないこと。副作用として肝障害が報告されており、悪化するおそれがある。
肝障害又はその既往歴のある患者(重篤な肝障害のある患者を除く)
副作用として肝障害が報告されており、悪化あるいは再発させることがある。
妊婦
妊娠後期の女性
投与しないこと。動物実験(ラット)で分娩障害が報告されている。また、妊娠後期のラットに投与した実験で、胎児の動脈管収縮が報告されている。
妊婦(妊娠後期を除く)又は妊娠している可能性のある女性
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。投与する際には、必要最小限にとどめ、適宜羊水量を確認するなど慎重に投与すること。シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
小児等
高齢者
本剤は、主として腎臓から排泄され、また、血漿アルブミンとの結合性が強い薬物であるので、腎機能の低下により高い血中濃度が持続したり、血漿アルブミンの減少により、遊離の薬物の血中濃度が高くなるおそれがある。
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
クマリン系抗凝血剤 ワルファリン等 | プロトロンビン時間の延長(出血を伴うことがある)があらわれたとの報告がある。抗凝血作用を増強することがあるので、必要があれば減量すること。 | 本剤のヒトでの蛋白結合率は、99%と高く、蛋白結合率の高い薬剤と併用すると血中に活性型の併用薬が増加し、その薬剤の作用が増強されるためと考えられている。 |
チアジド系利尿降圧剤 ヒドロフルメチアジド ヒドロクロロチアジド等 | 利尿降圧作用を減弱するおそれがある。 | 本剤の腎におけるプロスタグランジン生合成阻害作用により、水、Naの排泄を減少させるためと考えられている。 |
リチウム製剤 炭酸リチウム | 血中リチウム濃度を上昇させ、リチウム中毒を起こすおそれがあるので、血中のリチウム濃度に注意し、必要があれば減量すること。 | 本剤の腎におけるプロスタグランジン生合成阻害作用により、炭酸リチウムの腎排泄を減少させるためと考えられている。 |
メトトレキサート | メトトレキサートの血中濃度を高めるおそれがあるので、観察を十分に行うこと。 | 本剤の腎におけるプロスタグランジン生合成阻害作用により、メトトレキサートの腎排泄を減少させるためと考えられている。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
ショック(頻度不明)
アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、蕁麻疹、全身潮紅、血管浮腫、喘鳴等)があらわれることがある。
消化性潰瘍(穿孔を伴うことがある)(0.1%未満)
穿孔に至る場合もあるので、異常(胃痛、嘔吐、吐血・下血等を伴う胃腸出血)が認められた場合には、必要に応じて減量、休薬、投与中止等の適切な処置を行うこと。
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
汎血球減少、溶血性貧血、無顆粒球症、血小板減少(いずれも頻度不明)
腎不全(頻度不明)
急性腎障害(間質性腎炎、腎乳頭壊死等)や慢性腎不全の急性増悪があらわれることがある。
肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。
うっ血性心不全(頻度不明)
好酸球性肺炎、間質性肺炎(いずれも頻度不明)
発熱、咳嗽、呼吸困難、胸部X線上の異常陰影等の異常が認められた場合には投与を中止し、副腎皮質ホルモン剤投与等の適切な処置を行うこと。
その他の副作用
| 0.1~5%未満 | 0.1%未満 | 頻度不明 |
|---|
皮膚 | 発疹、そう痒感 | 蕁麻疹 | 紅斑、光線過敏症、紫斑、斑状出血、皮膚血管炎(白血球破砕性血管炎を含む) |
|---|
消化器 | 腹痛、悪心・嘔吐、食欲不振、下痢、口内炎、消化不良、腹部膨満感、舌炎、口渇 | 胃炎、便秘 | しゃっくり |
|---|
精神神経系 | めまい | しびれ、眠気、頭痛 | 振戦 |
|---|
肝臓 | 肝機能異常(AST、ALT、Al-Pの上昇等) | | |
|---|
腎臓 | 腎機能異常(蛋白尿、BUNの上昇等)、顕微鏡的血尿 | | |
|---|
血液 | 貧血 | 好酸球増多 | 白血球減少 |
|---|
その他 | 発熱、胸痛 | 浮腫、倦怠感、ほてり | 発赤、排尿困難、動悸、喘息、味覚異常、視覚異常(かすみ目等) |
|---|
臨床検査結果に及ぼす影響
ビリルビン試験で偽陽性を示すことがある(尿中に排泄されるフェノール性代謝物による)。
過量投与
症状
非ステロイド性消炎鎮痛剤の過量投与時の一般的な症状は、嗜眠、傾眠、悪心・嘔吐、心窩部痛である。
適用上の注意
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
その他の注意
臨床使用に基づく情報
国内において1日600mgを超える用量での臨床試験は実施していない。
非ステロイド性消炎鎮痛剤を長期間投与されている女性において、一時的な不妊が認められたとの報告がある。
薬物動態
血中濃度
生物学的同等性試験
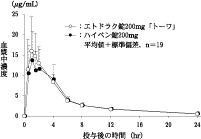
〈エトドラク錠200mg「トーワ」〉
エトドラク錠200mg「トーワ」とハイペン錠200mgを、クロスオーバー法によりそれぞれ1錠(エトドラクとして200mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
| 判定パラメータ | 参考パラメータ |
AUC0-24hr
(μg・hr/mL) | Cmax
(μg/mL) | Tmax
(hr) | t1/2
(hr) |
エトドラク錠200mg「トーワ」 | 86.12±17.25 | 19.74±6.21 | 1.50±1.00 | 7.58±2.32 |
ハイペン錠200mg | 83.26±18.07 | 17.55±4.45 | 1.92±1.20 | 8.66±5.26 |
有効成分に関する理化学的知見
一般的名称
エトドラク(Etodolac)
化学名
2-[(1RS)-1,8-Diethyl-1,3,4,9-tetrahydropyrano[3,4-b]indol-1-yl]acetic acid
分子式
C17H21NO3
分子量
287.35
性状
白色~微黄色の結晶又は結晶性の粉末である。メタノール又はエタノール(99.5)に溶けやすく、水にほとんど溶けない。メタノール溶液(1→50)は旋光性を示さない。
化学構造式
融点
約147℃(分解)
包装
〈エトドラク錠100mg「トーワ」〉
100錠[10錠×10:PTP]
〈エトドラク錠200mg「トーワ」〉
100錠[10錠×10:PTP]
1000錠[10錠×100:PTP]
1000錠[バラ]
主要文献
1
本谷 宣彦ほか:診療と新薬.2003;40(1):51-54
文献請求先及び問い合わせ先
〒570-0081 大阪府守口市日吉町2丁目5番15号
製造販売業者等





 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379