1
石郷岡純 他:臨床評価. 1993;21:441-490
2
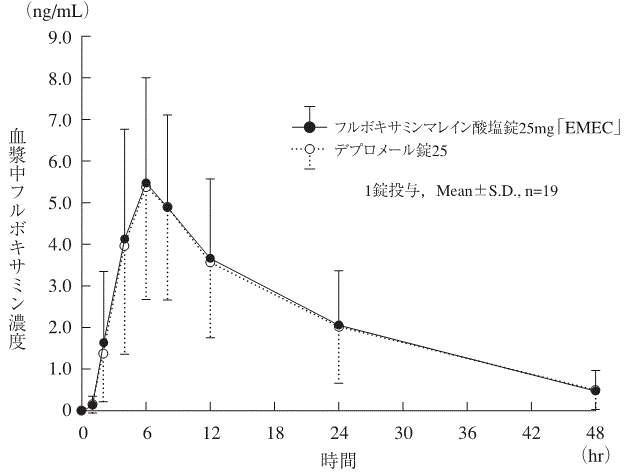
社内資料:生物学的同等性試験(錠25mg)
3
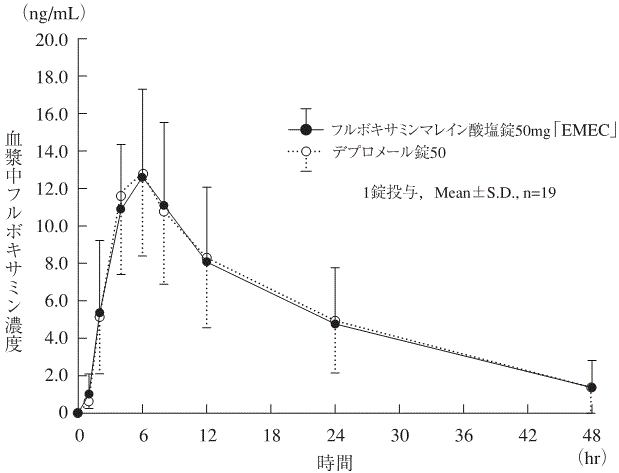
社内資料:生物学的同等性試験(錠50mg)
4
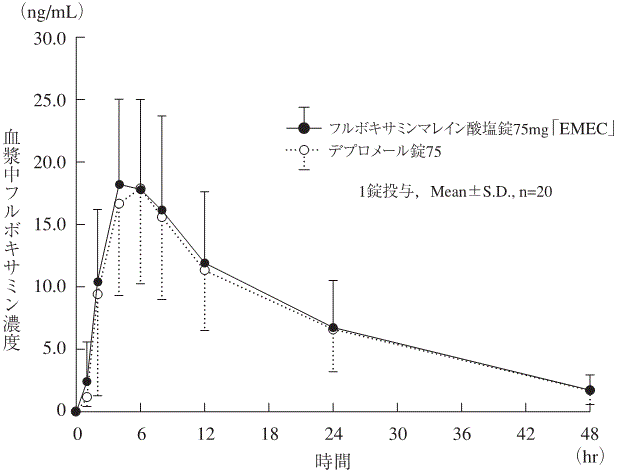
社内資料:生物学的同等性試験(錠75mg)
5
佐藤信雄 他:薬理と治療. 1995;23:637-643
6
Jeppesen U., et al.:Clin. Pharmacol. Ther. 1997;62:279-286
7
Perucca E., et al.:Clin. Pharmacokinet. 1994;27:175-190
8
欧米人小児患者反復投与薬物動態試験(ルボックス錠/デプロメール錠:2017年7月3日承認、申請資料概要2.7.2.2)
9
村崎光邦 他:臨床精神薬理. 1998;1:185-198
10
並木正義 他:臨床医薬. 1996;12:243-260
11
村崎光邦 他:臨床医薬. 1998;14:919-949
12
村崎光邦 他:臨床医薬. 1998;14:951-980
13
並木正義 他:臨床医薬. 1996;12:651-677
14
筒井末春 他:臨床医薬. 1996;12:261-275
15
岡五百理 他:臨床医薬. 1996;12:471-487
16
中嶋照夫 他:臨床医薬. 1998;14:567-588
17
中嶋照夫 他:臨床医薬. 1998;14:589-616
18
中嶋照夫 他:臨床医薬. 1996;12:679-700
19
フルボキサミンの小児強迫性障害患者を対象とした国内臨床試験のまとめ(ルボックス錠/デプロメール錠:2017年7月3日承認、申請資料概要2.7.6.3、2.7.6.6、2.7.6.9)
20
小児強迫性障害患者を対象とした国内第Ⅲ相試験(ルボックス錠/デプロメール錠:2017年7月3日承認、審査報告書7.2.1)
21
Asakura S., et al.:International J. Neuropsychopharmacology. 2007;10:263-274
22
社会不安障害患者を対象とした有効性検証試験・長期投与試験(ルボックス錠/デプロメール錠:2005年10月11日承認、申請資料概要2.7.3.2)
23
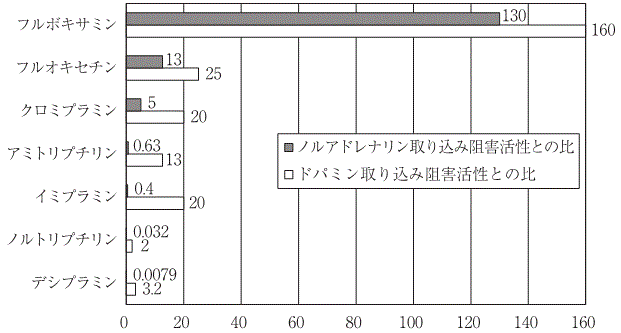
Claassen V.:Br. J. Clin. Pharmacol. 1983;15:349S-355S
24
Egawa T., et al.:Jpn. J. Pharmacol. 1995;68:71-75
25
市丸保幸 他:応用薬理. 1995;49:375-378
26
Ichimaru Y., et al.:Jpn. J. Pharmacol. 1995;68:65-70
27
Yamauchi M., et al.:Pharmacol. Biochem. Behav. 2004;78:683-689