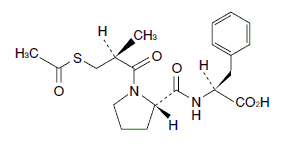
1
阿部真也 他:周産期医学.2017;47:1353-1355
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌.2021;29:49-54
3
荻原俊男 他:薬理と治療. 1985;13:2007-2038
4
荻原俊男 他:Ther. Res. 1985;3:1215-1224
5
Ogihara T., et al.:Curr. Ther. Res. 1987;42:324-334
6
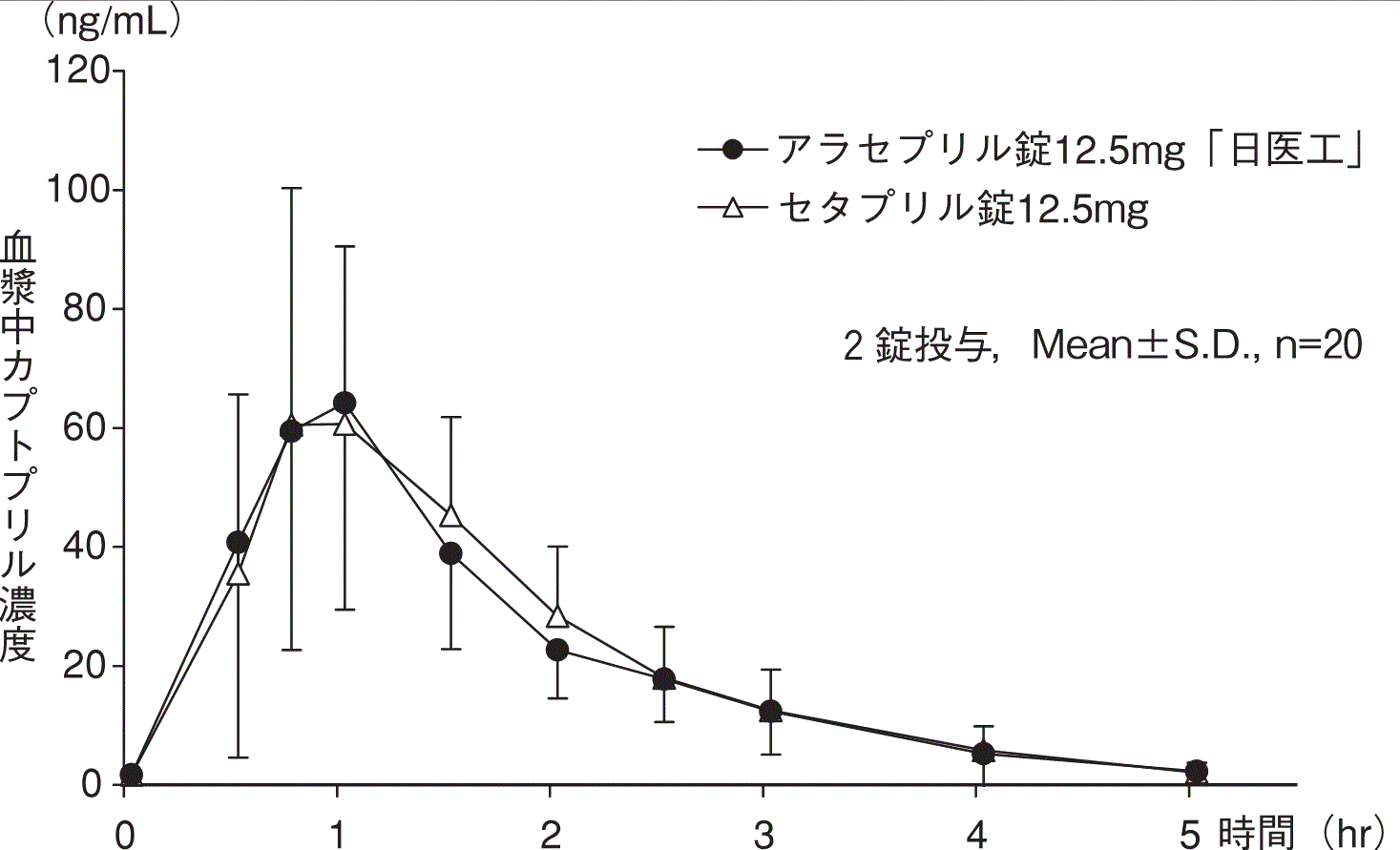
社内資料:生物学的同等性試験(錠12.5mg)
7
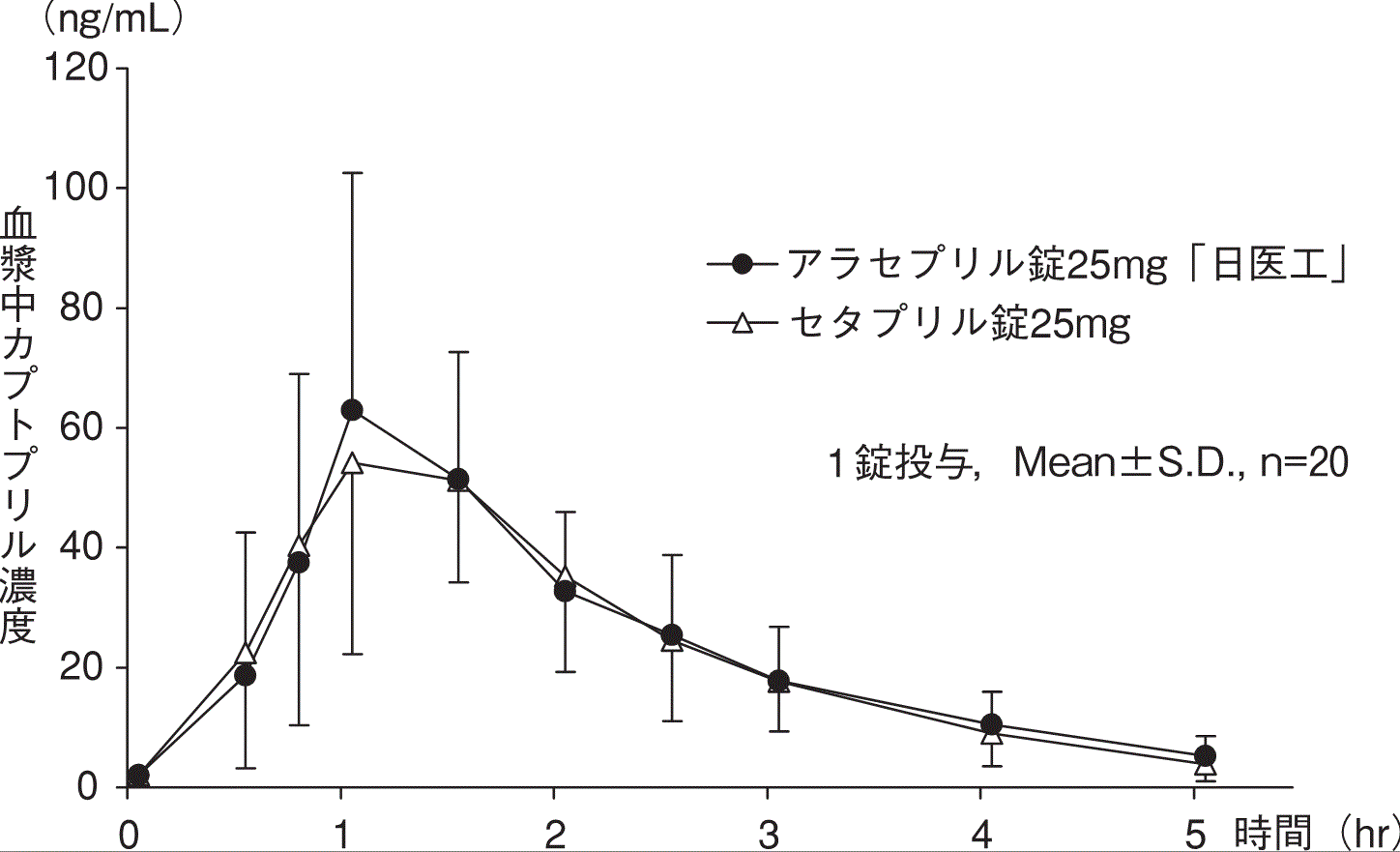
社内資料:生物学的同等性試験(錠25mg)
8
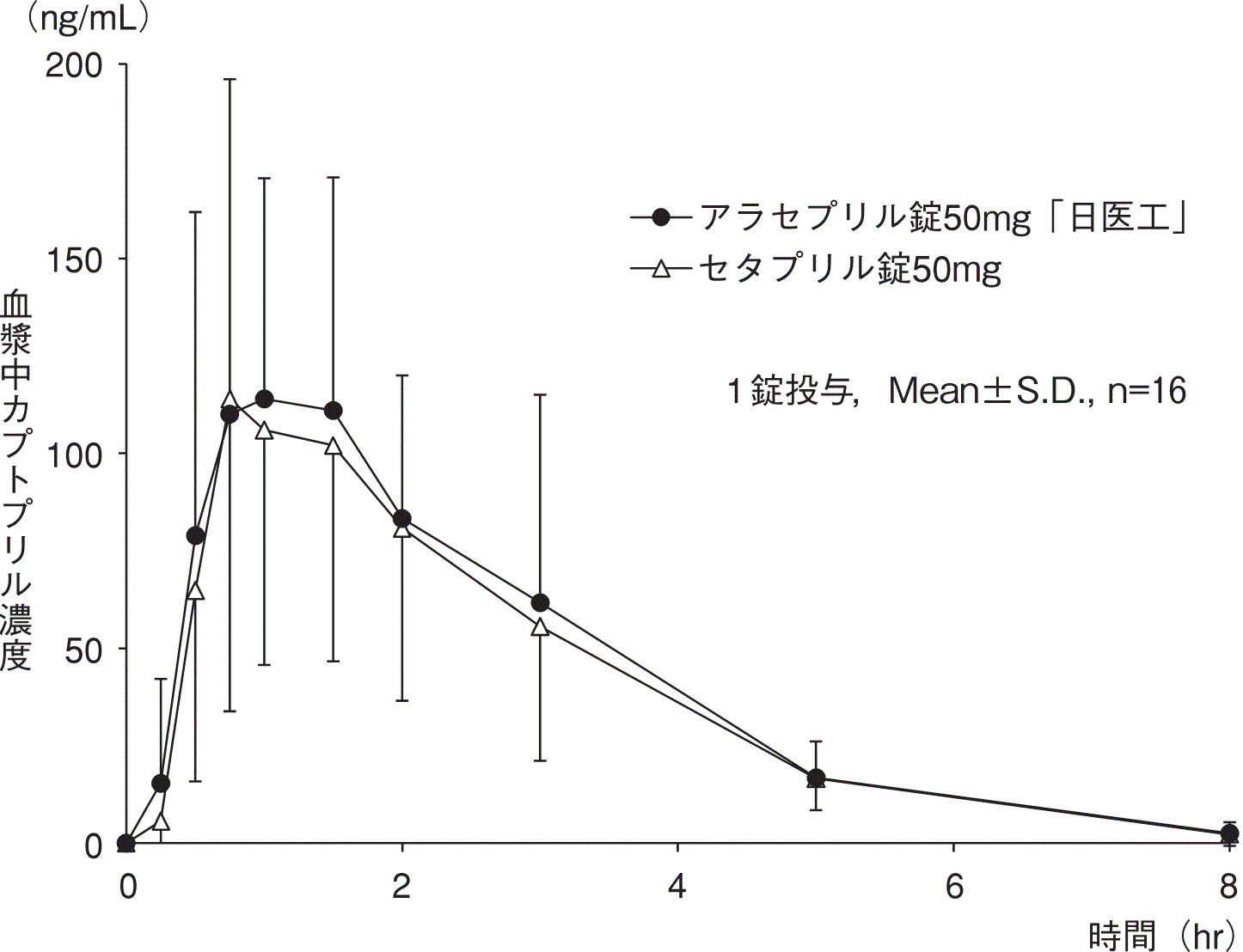
社内資料:生物学的同等性試験(錠50mg)
9
松本堅志 他:薬理と治療. 1985;13:4389-4402
10
小野山薫 他:薬理と治療. 1985;13:5801-5815
11
第十八改正日本薬局方解説書 廣川書店 2021;C339-C344
12
林幸司 他:薬理と治療. 1988;16:637-656
13
Matsumoto K., et al.:Arzneim.-Forsch./Drug Res. 1986;36:40-46
14
小野山薫 他:基礎と臨床. 1985;19:5943-5950
15
池田正男 他:臨床医薬. 1986;2:527-565
16
池田正男 他:臨床医薬. 1986;2:567-604
17
Takeyama K., et al.:Arzneim.-Forsch./Drug Res. 1985;35:1502-1507
18
Hosoki K., et al.:Arzneim.-Forsch./Drug Res. 1986;36:77-83
19
Takeyama K., et al.:Arzneim.-Forsch./Drug Res. 1986;36:74-77
20
Minato H., et al.:Arzneim.-Forsch./Drug Res. 1989;39:319-324
21
塩之入洋 他:医学と薬学. 1987;18:1809-1815






 094
094 094
094