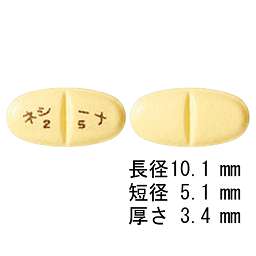
1
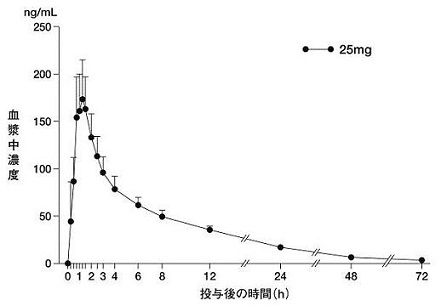
アログリプチンの薬物動態試験成績①(2010年4月16日承認:CTD2.7.6.6)
2
アログリプチンの薬物動態試験成績②(2010年4月16日承認:CTD2.7.6.27)
3
アログリプチンの薬物動態試験成績③(2010年4月16日承認:CTD2.7.6.2)
4
アログリプチンの蛋白結合に関する検討(2010年4月16日承認:CTD2.7.2.2)
5
アログリプチンの代謝に関する検討①(2010年4月16日承認:CTD2.5.3.2)
6
アログリプチンの代謝に関する検討②(2010年4月16日承認:CTD2.7.2.3)
7
アログリプチンの薬物動態試験成績④(2010年4月16日承認:CTD2.7.6.7)
8
アログリプチンの薬物動態試験成績⑤(2010年4月16日承認:CTD2.7.2.2)
9
腎機能障害者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.14)
10
肝機能障害者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.15)
11
高齢者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.13)
12
ボグリボースとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.6.17)
13
ピオグリタゾンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
14
グリベンクラミドとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.6.21)
15
メトホルミン又はシメチジンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
16
フルコナゾール、ケトコナゾール又はゲムフィブロジルとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
17
シクロスポリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
18
カフェイン、トルブタミド、デキストロメトルファン、ミダゾラム及びフェキソフェナジンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
19
ワルファリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
20
アトルバスタチンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
21
エチニルエストラジオール及びノルエチンドロンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
22
ジゴキシンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
23
アログリプチンの臨床試験成績①(2010年4月16日承認:CTD2.7.6.35)
24
アログリプチンの臨床試験成績②(2010年4月16日承認:CTD2.7.3.3)
25
アログリプチンの臨床試験成績③(2010年4月16日承認:CTD2.7.6.30)
26
アログリプチンの臨床試験成績④(2010年4月16日承認:CTD2.7.6.28)
27
アログリプチンの臨床試験成績⑤(2010年8月20日承認:CTD2.7.6.2)
28
アログリプチンの臨床試験成績⑥(2011年2月23日承認:CTD2.7.6.3)
29
アログリプチンの臨床試験成績⑦(2011年2月23日承認:CTD2.7.6.4)
30
アログリプチンの臨床試験成績⑧(2010年8月20日承認:CTD2.7.6.36)
31
アログリプチンの臨床試験成績⑨(2010年8月20日承認:CTD2.7.6.7)
32
アログリプチンの臨床試験成績⑩(2011年2月23日承認:CTD2.7.6.7)
33
アログリプチンの臨床試験成績⑪(2014年5月23日承認:CTD2.7.3.3)
34
アログリプチンの臨床試験成績⑫(2014年5月23日承認:CTD2.7.6.10)
35
アログリプチンの臨床試験成績⑬(2014年5月23日承認:CTD2.7.6.2)
36
アログリプチンの耐糖能改善作用に関する検討①(2010年4月16日承認:CTD2.4.1)
37
アログリプチンの耐糖能改善作用に関する検討②(2010年4月16日承認:CTD2.6.1)
38
アログリプチンの酵素阻害活性に関する検討(2010年4月16日承認:CTD2.6.2.1)
39
アログリプチンの耐糖能改善作用に関する検討③(2010年4月16日承認:CTD2.6.2.2)