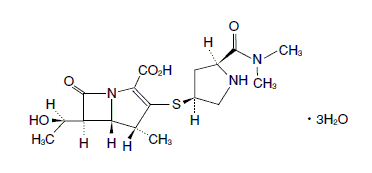
カルバペネム系抗生物質製剤
1キット 842円
| 剤形・性状 | 用時溶解して用いる注射剤 白色〜淡黄色の結晶性の粉末 |
|---|---|
| pH | 7.3〜8.3〔0.25g(力価)/5mL(水)〕 |
| 生理食塩液に溶解後のpH及び浸透圧比 | |
| 単位/容量 | 0.25g(力価)/100mL |
| pH | 6.9〜8.9 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 0.5g(力価)/100mL |
| pH | 6.8〜8.8 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 1g(力価)/100mL |
| pH | 6.7〜8.7 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 2g(力価)/100mL |
| pH | 6.7〜8.7 |
| 浸透圧比 | 約1〜2(生理食塩液に対する比) |
| 剤形・性状 | 用時溶解して用いる注射剤 白色〜淡黄色の結晶性の粉末 |
|---|---|
| pH | 7.3〜8.3〔0.25g(力価)/5mL(水)〕 |
| 生理食塩液に溶解後のpH及び浸透圧比 | |
| 単位/容量 | 0.25g(力価)/100mL |
| pH | 6.9〜8.9 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 0.5g(力価)/100mL |
| pH | 6.8〜8.8 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 1g(力価)/100mL |
| pH | 6.7〜8.7 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 2g(力価)/100mL |
| pH | 6.7〜8.7 |
| 浸透圧比 | 約1〜2(生理食塩液に対する比) |
| 剤形・性状 | 注射剤(用時溶解)本体と,溶解液(生理食塩液)からなるバッグ製品 白色〜淡黄色の結晶性の粉末 |
|---|---|
| pH | 7.3〜8.3〔0.25g(力価)/5mL(水)〕 |
| 生理食塩液に溶解後のpH及び浸透圧比 | |
| 単位/容量 | 0.25g(力価)/100mL |
| pH | 6.9〜8.9 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 0.5g(力価)/100mL |
| pH | 6.8〜8.8 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 1g(力価)/100mL |
| pH | 6.7〜8.7 |
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 単位/容量 | 2g(力価)/100mL |
| pH | 6.7〜8.7 |
| 浸透圧比 | 約1〜2(生理食塩液に対する比) |

| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| バルプロ酸ナトリウム デパケン バレリン ハイセレニン等 | 本剤との併用により,バルプロ酸の血中濃度が低下し,てんかんの発作が再発することがある。 | 機序は解明されていない。 |
| 頻度不明 | |
| 過敏症注) | 発疹,発熱,蕁麻疹,紅斑,そう痒,発赤,熱感 |
| 血液注) | 顆粒球減少,好酸球増多,血小板減少又は増多,赤血球減少,ヘモグロビン減少,好塩基球増多,リンパ球増多,好中球増多,単球増多,ヘマトクリット減少,異型リンパ球出現 |
| 肝臓 | AST(GOT)上昇,ALT(GPT)上昇,LDH上昇,Al-P上昇,LAP上昇,γ-GTP上昇,ビリルビン上昇,尿ウロビリノーゲン上昇,黄疸,コリンエステラーゼ低下 |
| 腎臓 | BUN上昇,クレアチニン上昇,尿中β2-マイクログロブリン上昇,尿蛋白陽性 |
| 消化器 | 下痢,嘔気,嘔吐,腹痛,食欲不振 |
| 菌交代症 | 口内炎,カンジダ症 |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症,出血傾向等),ビタミンB群欠乏症状(舌炎,口内炎,食欲不振,神経炎等) |
| その他 | 血清カリウム上昇,頭痛,けん怠感,不穏,血清ナトリウム低下,血清カリウム低下,CK(CPK)上昇,トリグリセリド増加,胸部不快感,血中尿酸減少又は増加,注射部位反応(炎症,疼痛,硬結等),ミオクローヌス,せん妄 |