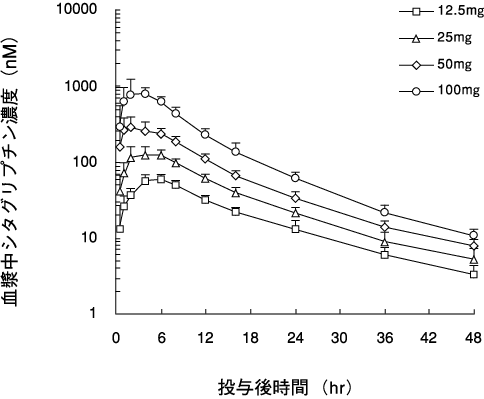
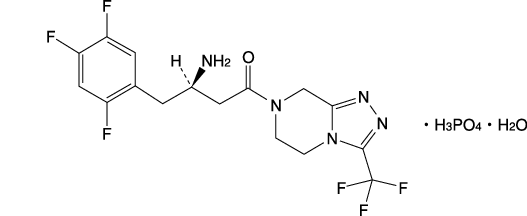
1
Herman GA, et al. Br J Clin Pharmacol. 2011;71:429-436.
2
片山泰之、他. 新薬と臨床. 2011;60:1139-1152.
3
Bergman A, et al. Biopharma Drug Dispos. 2007;28:315-322.
4
Vincent SH, et al. Drug Metab Dispos. 2007;35:533-538.
5
Chu XY, et al. J Pharmacol Exp Ther. 2007;321:673-683.
6
Bergman AJ, et al. Diabetes Care. 2007;30:1862-1864.
7
Migoya EM, et al. Can J Clin Pharmacol. 2009;16:e165-170.
8
Krishna R, et al. J Clin Pharmacol. 2007;47:165-174.
9
Herman GA, et al. Curr Med Res Opin. 2006;22:1939-1947.
10
Mistry GC, et al. J Clin Pharmacol. 2007;47:159-164.
11
Mistry GC, et al. Br J Clin Pharmacol. 2008;66:36-42.
12
Bergman AJ, et al. J Clin Pharmacol. 2009;49:483-488.
13
Wright DH, et al. J Clin Pharmacol. 2009;49:1157-1167.
14
Migoya E, et al. J Clin Pharmacol. 2011;51:1319-1325.
15
Iwamoto Y, et al. Endocr J. 2010;57:383-394.
16
Iwamoto Y, et al. Diabetes Obes Metab. 2010;12:613-622.
17
Odawara M, et al. Diabetol Int. 2011;2:94-105.
18
Tajima N, et al. Diabetol Int. 2011:2:32-44.
19
Kashiwagi A, et al. J Diabetes Investig. 2011;2:381-390.
20
Kadowaki T, et al. J Diabetes Investig. 2013;4:174-181.
21
Tajima N, et al. J Diabetes Investig. 2013;4:595-604.
22
Tajima N, et al. Diabetol Int. 2016;7:155-166.
23
Kadowaki T, et al. Diabetol Int. 2013;4:160-172.
24
Drucker DJ, Diabetes Care. 2003;26:2929-2940.
25
Kim D, et al. J Med Chem. 2005;48:141-151.
26
Herman GA, et al. J Clin Endocrinol Metab. 2006;91:4612-4619.
27
シタグリプチンのin vitro及びin vivo薬理試験(2009年10月16日承認、CTD 2.6.2.2)
28
Nonaka K, et al. Diabetes Res Clin Pract. 2008;79:291-298.