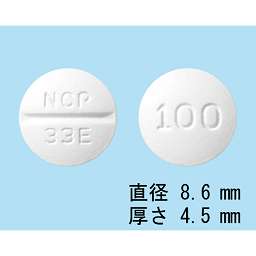
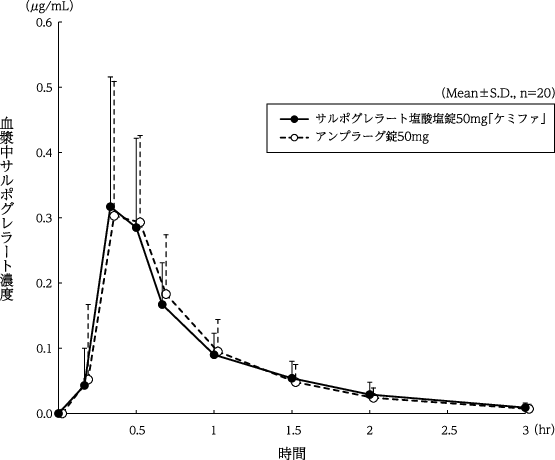
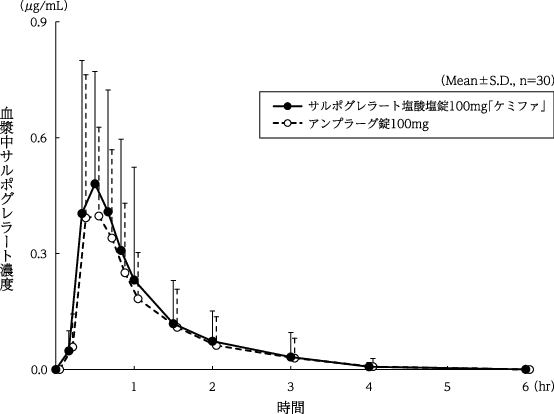
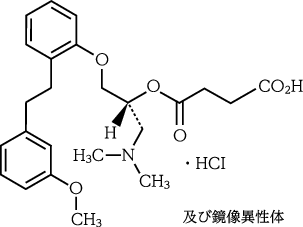
1
日本ケミファ株式会社:生物学的同等性に関する資料(社内資料)
2
小松貞子, 他: 薬物動態. 1991; 6(3): 353-375
3
小松貞子, 他: 薬物動態. 1991; 6(3): 377-398
4
丹羽卓朗, 他: 薬理と治療. 1991; 19: S749-756
5
第十八改正日本薬局方解説書 廣川書店 2021: C2091-2095
6
古川欽一, 他: 臨床医薬. 1991; 7(8): 1747-1770
7
原 啓人, 他: Thromb Haemost. 1991; 65(4): 415-420
8
原 啓人, 他: 薬理と治療. 1991; 19: S611-618
9
土橋洋史, 他: J Pharmacobiodyn. 1991; 14(8): 461-466
10
丸山恵子, 他: J Pharmacobiodyn. 1991; 14(4): 177-181
11
山口 寛, 他: 臨床医薬. 1991; 7(6): 1235-1241
12
磯貝行秀, 他: 臨床医薬. 1991; 7(6): 1227-1233
13
原 啓人, 他: Arzneimittelforschung. 1991; 41(6): 616-620
14
原 啓人, 他: Thromb Haemost. 1991; 66(4): 484-488
15
伊藤勝朗, 他: 臨床医薬. 1991; 7(6): 1243-1251