1
齋藤 滋 他:日本産婦人科・新生児血液学会誌. 2011;21(1):9-13
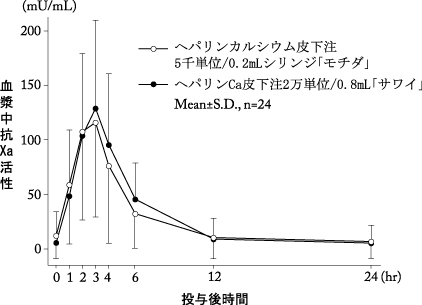
2
持田製薬社内資料:生物学的同等性試験
3
第十八改正日本薬局方解説書. 廣川書店;2021. C-5238-5251
4
Lavelle, S. M. et al.:Ir. J. Med. Sci. 1980;149(7):266-269
血液凝固阻止剤
1筒 465円
有効成分 | 日局 ヘパリンカルシウム(ブタ腸粘膜由来) 5,000単位 |
|---|---|
添加剤 | グルコン酸カルシウム水和物 2mg トロメタモール 1.2mg 塩酸 適量 水酸化ナトリウム 適量 |
| pH | 6.0~7.5 |
|---|---|
| 浸透圧比 | 約0.7(生理食塩液に対する比) |
| 性状 | 無色~淡黄色澄明の液(水性注射剤) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
抗凝固剤 | 本剤の作用が出血傾向を増強するおそれがある。 | 本剤の抗凝固作用と血液凝固因子の生合成阻害作用により相加的に出血傾向が増強される。 |
血栓溶解剤 ウロキナーゼ t-PA製剤 等 | 本剤の作用が出血傾向を増強するおそれがある。 | 本剤の抗凝固作用とフィブリン溶解作用により相加的に出血傾向が増強される。 |
血小板凝集抑制作用を有する薬剤 アスピリン ジピリダモール チクロピジン塩酸塩 等 | 本剤の作用が出血傾向を増強するおそれがある。 | 本剤の抗凝固作用と血小板凝集抑制作用により相加的に出血傾向が増強される。 |
テトラサイクリン系抗生物質 強心配糖体 ジギタリス製剤 ニトログリセリン製剤 | 本剤の作用が減弱することがある。 | 機序は不明である。 |
筋弛緩回復剤 スガマデクスナトリウム | 本剤の抗凝固作用が増強されるおそれがあるので、患者の状態を観察するとともに血液凝固に関する検査値に注意すること。 | 作用機序は不明であるが、スガマデクスナトリウム4mg/kgと抗凝固剤の併用中に活性化部分トロンボプラスチン時間(APTT)又はプロトロンビン時間(PT)の軽度で一過性の延長が認められている。 |
頻度不明 | |
|---|---|
過敏症 | そう痒感、蕁麻疹、悪寒、発熱、鼻炎、気管支喘息、流涙等 |
皮膚 | 脱毛、白斑、出血性壊死等 |
肝臓 | AST上昇、ALT上昇 |
長期投与 | 骨粗鬆症、低アルドステロン症 |
投与部位 | 発赤、腫脹、硬結、そう痒感、局所の疼痛性血腫等 |
投与量 | Amax (mU/mL) | AUAC24hr (mU・hr/mL) | tmax (hr) | |
ヘパリンカルシウム皮下注 5千単位/0.2mL シリンジ「モチダ」 | 5,000単位/ 0.2mL | 121.2±84.1 (n=24) | 671.50±606.67 (n=24) | 2.7±0.5 (n=21) |
ヘパリンCa皮下注 2万単位/0.8mL「サワイ」 | 5,000単位/ 0.2mL | 131.1±81.4 (n=24) | 728.54±504.47 (n=24) | 2.9±0.5 (n=22) |