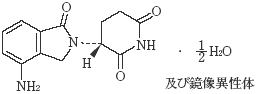
1
RevMate(レナリドミド・ポマリドミド適正管理手順)
2
Palumbo A, et al.:N Engl J Med. 2012; 366: 1759-1769.
3
McCarthy PL, et al.:N Engl J Med. 2012; 366: 1770-1781.
4
Attal M, et al.:N Engl J Med. 2012; 366: 1782-1791.
5
Dimopoulos MA, et al:Blood. 2012; 119: 2764-2767.
6
Chanan-Khan A, et al.:Leukemia. 2017; 31: 1240-1243.
7
社内資料:CC-5013-PK-005試験(承認年月日:2010年6月25日、CTD2.7.6.6)
8
社内資料:CC-5013-MM-017試験(承認年月日:2010年6月25日、CTD2.7.6.11)
9
Harada H, et al.:Int J Hematol. 2009; 90: 353-360.
10
社内資料:CC-5013-ATLL-001試験(承認年月日:2017年3月2日、CTD2.7.6.1)
11
社内資料:CC-5013-PK-009試験(承認年月日:2010年6月25日、CTD2.7.6.1)
12
Chen N, et al.:J Clin Pharmacol. 2010; 50: 767-774.
13
社内資料:CC-5013-PK-008試験(承認年月日:2010年6月25日、CTD2.7.6.8)
14
社内資料:健康人でのレナリドミドの薬物動態(承認年月日:2010年6月25日、CTD2.5.3.1)
15
社内資料:CC-5013-PK-001試験(承認年月日:2010年6月25日、CTD2.7.6.12)
16
社内資料:CC-5013-PK-004試験(承認年月日:2010年6月25日、CTD2.7.6.14)
17
Iida S, et al.:Int J Hematol. 2010; 92: 118-126.
18
Chen N, et al.:Cancer Chemother Pharmacol. 2014; 73: 1031-1039.
19
Suzuki K, et al.:Cancer Sci. 2016; 107: 653-658.
20
Benboubker L, et al.:N Engl J Med. 2014; 371: 906-917.
21
社内資料:CC-5013-MM-009試験(承認年月日:2010年6月25日、CTD2.7.6.15)
22
Fenaux P, et al.:Blood. 2011; 118: 3765-3776.
23
社内資料:CC-5013-ATLL-002試験(承認年月日:2017年3月2日、CTD2.7.6.3)
24
社内資料:CC-5013-NHL-007試験(承認年月日:2020年2月21日、CTD2.7.6.1)
25
社内資料:薬理試験の概要文(承認年月日:2010年6月25日、CTD2.6.2)
26
Gandhi AK, et al.:Curr Cancer Drug Targets. 2010; 10: 155-167.
27
社内資料:薬理試験の概要文(承認年月日:2017年3月2日、CTD2.6.2)
28
社内資料:薬理試験の概要文(承認年月日:2020年2月21日、CTD2.6.2)