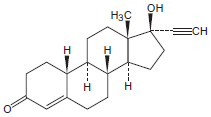
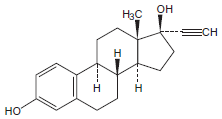
1
Farquhar C, et al.,Oral contraceptive pill, progestogen or oestrogen pretreatment for ovarian stimulation protocols for women undergoing assisted reproductive techniques. Cochrane Database Syst Rev 2017; 5: CD006109
2
社内資料:健康成人女性への単回経口投与後の血中濃度検討(2008年4月16日承認、申請資料概要2.7.6.1)
3
社内資料:臨床第I相試験-反復経口投与試験(2008年4月16日承認、申請資料概要2.7.2.2)
4
社内資料:健康成人女性への単回経口投与試験(2013年6月28日承認、申請資料概要2.7.6U.1)
5
Orme ML’ E, et al. Clin. Pharmacokinet. 1983; 8: 95-136.
6
百瀬裕子ほか, 基礎と臨床 1990; 24: 4841-4872.
7
Harada T, et al. Fertil. Steril. 2008; 90: 1583-1588.
8
社内資料:第III相比較試験-プラセボ対照二重盲検試験(2008年4月16日承認、申請資料概要2.7.6.3)
9
百枝幹雄ほか, 産科と婦人科 2008; 75: 1165-1181.
10
社内資料:第III相長期投与試験(2008年4月16日承認、申請資料概要2.7.6.4)
11
Harada T, et al. Fertil. Steril. 2011; 95: 1928-1931.
12
社内資料:第III相比較試験-プラセボ対照二重盲検試験(2010年12月21日承認、申請資料概要2.7.6.1)
13
社内資料:第III相比較試験-プラセボ対照二重盲検試験(2013年6月28日承認、申請資料概要2.7.6U.3)
14
社内資料:第III相長期投与試験(2013年6月28日承認、申請資料概要2.7.6U.4)
15
社内資料:健康成人女性への反復経口投与試験(2013年6月28日承認、申請資料概要2.7.6U.2)