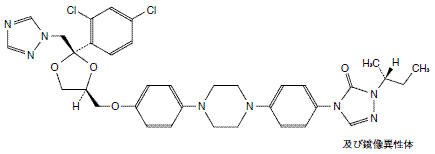
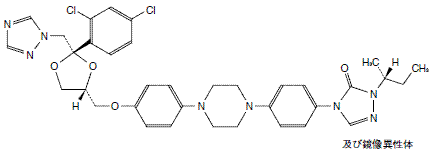
経口抗真菌剤
1錠 162円
| 剤形 | 素錠 |
|---|---|
| 色調 | 帯黄白色〜黄白色 |
| 外形 |  |
| 外形 |  |
| 直径(mm) | 9.0 |
| 厚さ(mm) | 4.3 |
| 質量(mg) | 250 |
| 本体コード |  62E 62E |
| 包装コード |  62E 62E |
| 剤形 | 素錠 |
|---|---|
| 色調 | 帯黄白色〜黄白色 |
| 外形 |  |
| 外形 |  |
| 直径(mm) | 14.1×7.1 |
| 厚さ(mm) | 4.9 |
| 質量(mg) | 410 |
| 本体コード |  62H 62H |
| 包装コード |  538 538 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ピモジド (オーラップ) キニジン ベプリジル (ベプリコール) | これらの薬剤の血中濃度上昇により,QT延長が発現する可能性がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| トリアゾラム (ハルシオン) | トリアゾラムの血中濃度上昇,作用の増強,作用時間の延長があらわれることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| シンバスタチン (リポバス) | シンバスタチンの血中濃度上昇により,横紋筋融解症があらわれやすくなる。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| アゼルニジピン (カルブロック) (レザルタス配合錠) ニソルジピン | これらの薬剤の血中濃度を上昇させることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| エルゴタミン (クリアミン配合錠) ジヒドロエルゴタミン エルゴメトリン (エルゴメトリンマレイン酸塩注) メチルエルゴメトリン (パルタンM) | これらの薬剤の血中濃度上昇により,血管攣縮等の副作用が発現するおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| バルデナフィル (レビトラ) | バルデナフィルのAUCが増加しCmaxが上昇するとの報告がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| エプレレノン (セララ) | エプレレノンの血中濃度を上昇させるおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ブロナンセリン (ロナセン) | ブロナンセリンの血中濃度が上昇し,作用が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| シルデナフィル (レバチオ) | シルデナフィルの血中濃度を上昇させるおそれがある(シルデナフィルとリトナビルの併用により,シルデナフィルのCmax及びAUCがそれぞれ3.9倍及び10.5倍に増加したとの報告がある)。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| タダラフィル (アドシルカ) | タダラフィルの血中濃度を上昇させるおそれがある(タダラフィルとケトコナゾールの併用により,タダラフィルのAUC及びCmaxがそれぞれ312%及び22%増加したとの報告がある)。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| スボレキサント (ベルソムラ) | スボレキサントの作用を著しく増強させるおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| イブルチニブ (イムブルビカ) | イブルチニブの血中濃度が上昇し,副作用が増強されるおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| チカグレロル (ブリリンタ) | チカグレロルの血中濃度が上昇し,出血の危険性が増大するおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ロミタピド (ジャクスタピッド) | ロミタピドの血中濃度が著しく上昇するおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| イバブラジン (コララン) | イバブラジンの血中濃度が上昇し,過度の徐脈があらわれることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期) (ベネクレクスタ) | ベネトクラクスの血中濃度が上昇し,腫瘍崩壊症候群の発現が増強する可能性がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ルラシドン塩酸塩 (ラツーダ) | ルラシドン塩酸塩の血中濃度が上昇し,作用が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| アナモレリン塩酸塩 (エドルミズ) | アナモレリン塩酸塩の血中濃度が上昇し,副作用の発現が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| *フィネレノン (ケレンディア) | フィネレノンの血中濃度が著しく上昇するおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| アリスキレン (ラジレス) | イトラコナゾールカプセルの併用投与(空腹時)により,アリスキレンのCmax及びAUCがそれぞれ約5.8倍及び約6.5倍に上昇したとの報告がある。 | 本剤のP糖蛋白阻害作用により,アリスキレンの排泄が阻害されると考えられる。 |
| ダビガトラン (プラザキサ) | ダビガトランの血中濃度が上昇し,出血の危険性が増大することがある。 | 本剤のP糖蛋白阻害作用により,ダビガトランの排泄が阻害されると考えられる。 |
| リバーロキサバン (イグザレルト) | リバーロキサバンの血中濃度が上昇し,出血の危険性が増大するおそれがある(リバーロキサバンとケトコナゾールの併用により,リバーロキサバンのAUC及びCmaxがそれぞれ158%及び72%増加したとの報告がある)。 | 本剤のCYP3A4及びP糖蛋白阻害作用により,リバーロキサバンの代謝及び排泄が阻害され,抗凝固作用が増強されると考えられる。 |
| リオシグアト (アデムパス) | リオシグアトの血中濃度を上昇させるおそれがある(リオシグアトとケトコナゾールの併用により,リオシグアトのAUC及びCmaxがそれぞれ150%及び46%増加し,また,消失半減期が延長し,クリアランスも低下したとの報告がある)。 | 本剤のCYP3A4及びP糖蛋白阻害作用により,リオシグアトのクリアランスが低下することが考えられる。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アトルバスタチン | 横紋筋融解症があらわれやすくなる。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ビンカアルカロイド系抗悪性腫瘍剤 ビンクリスチン等 | ビンカアルカロイド系抗悪性腫瘍剤の副作用が増強されることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| メチルプレドニゾロン デキサメタゾン ブデソニド | これらの薬剤の副作用が増強されることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| コルヒチン | コルヒチンの作用が増強されることがある。なお,肝臓又は腎臓に障害のある患者で,コルヒチンを投与中の患者には,本剤を併用しないこと。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ジソピラミド | ジソピラミドの血中濃度上昇により,QT延長が発現する可能性がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ベンゾジアゼピン系薬剤 ミダゾラム, ブロチゾラム, アルプラゾラム | これらの薬剤の血中濃度を上昇させることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| 抗精神病薬 ハロペリドール, アリピプラゾール, ペロスピロン, クエチアピン | これらの薬剤の血中濃度を上昇させることがある。 ・本剤とアリピプラゾールの併用により,アリピプラゾールのCmax,AUC,t1/2がそれぞれ19.4%,48.0%,18.6%増加したとの報告がある。 ・本剤とペロスピロンの併用により,ペロスピロンのCmax及びAUCがそれぞれ5.7倍及び6.8倍増加したとの報告がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| 免疫抑制剤 シクロスポリン, タクロリムス水和物 | これらの薬剤の血中濃度を上昇させることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| 抗悪性腫瘍剤 ドセタキセル水和物, エベロリムス, テムシロリムス, ゲフィチニブ, ダサチニブ, エルロチニブ, ラパチニブ, ボルテゾミブ, イマチニブ, スニチニブ, ボスチニブ, カバジタキセル, セリチニブ, クリゾチニブ, シロリムス(錠), パノビノスタット, ポナチニブ, ルキソリチニブ, アパルタミド, * トレチノイン(カプセル), ** ペミガチニブ, ** エヌトレクチニブ | これらの薬剤の血中濃度を上昇させることがある。 ・クリゾチニブ反復投与時に本剤を併用投与したとき,クリゾチニブの定常状態におけるAUCtau及びCmaxは単独投与と比べそれぞれ57%及び33%増加した。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| オピオイド系鎮痛剤 フェンタニル, オキシコドン, メサドン | これらの薬剤の血中濃度を上昇させることがある。 ・本剤とオキシコドンの併用により,オキシコドンのクリアランスが32%減少し,AUCが51%増加したとの報告がある(オキシコドン注射剤)。また,オキシコドンのAUCが144%上昇したとの報告がある(オキシコドン経口剤)。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ブプレノルフィン セレギリン ガランタミン モザバプタン トルバプタン エレトリプタン サルメテロール シクレソニド フルチカゾン アプレピタント イミダフェナシン ソリフェナシン トルテロジン シロスタゾール シナカルセト エバスチン ダルナビル マラビロク オキシブチニン ドンペリドン シロドシン キニーネ ゾピクロン グアンファシン ジエノゲスト | これらの薬剤の血中濃度を上昇させることがある。 ・トルバプタンとの併用が避けられない場合は,トルバプタンの減量あるいは,低用量から開始するなど用量に注意すること。 ・本剤とイミダフェナシンの併用により,イミダフェナシンのCmax及びAUCがそれぞれ1.32倍及び1.78倍増加したとの報告がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| シルデナフィル (バイアグラ) | シルデナフィルとエリスロマイシンの併用によりシルデナフィルのCmax,AUCの増加が認められたとの報告がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| タダラフィル (シアリス,ザルティア) | タダラフィルの血中濃度を上昇させるおそれがある(タダラフィルとケトコナゾールの併用により,タダラフィルのAUC及びCmaxがそれぞれ312%及び22%増加したとの報告がある)。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ワルファリン | ワルファリンの作用が増強し,著しいINR上昇があらわれることがある(「重要な基本的注意」の項参照)。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| アキシチニブ | アキシチニブの血中濃度が上昇し,副作用の発現頻度及び重症度が増加するおそれがある。やむを得ず併用する際にはアキシチニブの減量を考慮するとともに,患者の状態を慎重に観察し,副作用発現に十分注意すること。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| フェソテロジン | 活性代謝物5-HMTの血漿中濃度の上昇に伴い効果や副作用の増強が予想される。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ボセンタン | ボセンタンの血中濃度が上昇し,ボセンタンの副作用が発現しやすくなるおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| アルテメテル・ルメファントリン | アルテメテル及びルメファントリンの血中濃度が上昇し,QT延長が起こるおそれがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| デソゲストレル・エチニルエストラジオール | これらの薬剤の血中濃度を上昇させることがある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の維持投与期,急性骨髄性白血病) | ベネトクラクスの血中濃度が上昇し,副作用が増強する可能性があるので,ベネトクラクスを減量するとともに患者の状態を慎重に観察すること。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。 |
| ジヒドロピリジン系Ca拮抗剤 ニフェジピン, ニルバジピン, フェロジピン等 ベラパミル | これらの薬剤の血中濃度を上昇させることがある。また,心機能が低下する可能性がある。 | 本剤のCYP3A4に対する阻害作用により,これらの薬剤の代謝が阻害される。また,両剤の心抑制作用が増強する可能性がある。 |
| イリノテカン | イリノテカンの活性代謝物の血中濃度が上昇することがある。 | 本剤のCYP3A4阻害作用により,イリノテカンの活性代謝物の無毒化が阻害されると考えられる。 |
| **バルベナジン | バルベナジン及び活性代謝物の血漿中濃度が上昇するおそれがある。バルベナジンの作用が増強することで副作用があらわれるおそれがあるため,観察を十分に行うこと。本剤を併用する場合にはバルベナジンの増量はしないこと。 | 本剤のCYP3A阻害作用により,バルベナジン及び活性代謝物の代謝が阻害されると考えられる。 |
| ニロチニブ | ニロチニブの血中濃度が上昇し,QT延長があらわれることがある。 | 本剤のCYP3A4及びP糖蛋白阻害作用により,ニロチニブの代謝及び排泄が阻害されると考えられる。 |
| アピキサバン | アピキサバンの血中濃度を上昇させることがある。 | 本剤のCYP3A4及びP糖蛋白阻害作用により,アピキサバンの代謝及び排泄が阻害されると考えられる。 |
| *エドキサバン | エドキサバンの血中濃度を上昇させ,出血の危険性を増大させるおそれがある。 | 本剤のP糖蛋白阻害作用により,エドキサバンのバイオアベイラビリティを上昇させると考えられる。 |
| ジゴキシン ブスルファン | これらの薬剤の血中濃度を上昇させることがある。 本剤とブスルファンの併用により,ブスルファンのクリアランスが20%減少したとの報告がある。 | 機序不明 |
| ロペラミド | ロペラミドの血中濃度が上昇することがある。 | 本剤のCYP3A4及びP糖蛋白阻害作用により,ロペラミドの代謝及び排泄が阻害されると考えられる。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| クラリスロマイシン リトナビル ホスアンプレナビル/リトナビル エリスロマイシン シプロフロキサシン | 本剤の血中濃度が上昇することがある。 本剤とシプロフロキサシンの併用により,イトラコナゾールのCmax及びAUCがそれぞれ53.13%及び82.46%増加したとの報告がある。 | これらの薬剤のCYP3A4に対する阻害作用により,本剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ダルナビル/リトナビル | 本剤又はダルナビルの血中濃度が上昇する可能性がある(ダルナビル/リトナビルとケトコナゾールの併用により,ダルナビルとケトコナゾールの血中濃度の上昇が認められたとの報告がある)。 | 本剤及びこれらの薬剤のCYP3A4に対する阻害作用により,血中濃度の変化が起こる場合がある。 |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルアラフェナミドフマル酸塩 エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルジソプロキシルフマル酸塩 | 本剤,エルビテグラビル及びコビシスタットの血中濃度が上昇する可能性がある。 | 本剤及びコビシスタットのCYP3A等阻害作用により,相互に代謝が阻害される。 |
| ダルナビルエタノール付加物・コビシスタット | 本剤,ダルナビル又はコビシスタットの血中濃度が上昇する可能性がある。 | 本剤とダルナビル及びコビシスタットのCYP3A阻害作用により,相互に代謝が阻害される。 |
| ダルナビルエタノール付加物・コビシスタット・エムトリシタビン・テノホビルアラフェナミドフマル酸塩 | 本剤,ダルナビル,コビシスタット又はテノホビルアラフェナミドの血中濃度が上昇する可能性がある。 | 本剤とダルナビル,コビシスタット及びテノホビルアラフェナミドのCYP3A及びP糖蛋白阻害作用により,相互に代謝が阻害される。 |
| カルバマゼピン エトラビリン リファブチン | 本剤の血中濃度が低下することがある。また,これらの薬剤の血中濃度が上昇する可能性がある。 | これらの薬剤の肝薬物代謝酵素誘導により,本剤の肝代謝が促進される。また,本剤のCYP3A4に対する阻害作用によりこれらの薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| リファンピシン フェニトイン イソニアジド フェノバルビタール エファビレンツ ネビラピン | 本剤の血中濃度が低下することがある。 本剤とネビラピンの併用により,本剤のCmax,AUC及びt1/2がそれぞれ38%,61%及び31%減少したとの報告がある。 | これらの薬剤の肝薬物代謝酵素誘導により,本剤の肝代謝が促進される。 |
| H2遮断薬 | 本剤の血中濃度が低下することがある。併用する場合には両剤の投与間隔をできる限りあけるなど慎重に投与すること。 | 酸分泌量低下のため本剤の消化管での溶解性が低下し,吸収が低下することがある。 |
| プロトンポンプ阻害剤 オメプラゾール等 | 本剤の血中濃度が低下することがある。 | 酸分泌量低下のため本剤の消化管での溶解性が低下し,吸収が低下することがある。 |
| 制酸剤 乾燥水酸化アルミニウムゲル等 | 本剤と制酸剤の併用により,本剤のCmax及びAUCがそれぞれ70%及び66%減少したとの報告がある。 | 酸分泌量低下のため本剤の消化管での溶解性が低下し,吸収が低下することがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| メロキシカム | 本剤とメロキシカムの併用により,メロキシカムのCmax及びAUCがそれぞれ64%及び37%減少したとの報告がある。 | 本剤がメロキシカムの消化管からの吸収を抑制すると考えられる。 |
| 頻度不明 | |
| 感染症 | 鼻炎 |
| 過敏症 | 血管浮腫 |
| 循環器 | 不整脈,心室性期外収縮,房室ブロック,動悸,狭心症発作,徐脈,心電図異常,血管障害,血圧上昇,頻脈,高血圧,低血圧 |
| 消化器 | 腹痛,嘔気,便秘,下痢,嘔吐,消化不良,食欲不振,鼓腸放屁,おくび,舌炎,口内炎,腹部腰背部痛,軟便,腹部不快感,口腔内痛,歯周炎,胃炎,胃十二指腸潰瘍 |
| 肝臓 | 肝機能異常,AST(GOT)増加,ALT(GPT)増加,LDH増加,γ-GTP増加,Al-P増加,血中ビリルビン増加,LAP増加 |
| 呼吸器 | 咽喉頭疼痛,呼吸困難,咳嗽 |
| 皮膚 | 発疹,そう痒症,紅斑性発疹,脱毛,蕁麻疹,光線過敏性反応,白血球破砕性血管炎,湿疹,皮膚乾燥,皮膚腫脹 |
| 精神神経系 | |
| 腎臓 | BUNの上昇,尿蛋白及び尿糖の陽性,腎障害,頻尿,尿失禁,血尿,尿検査異常,尿円柱,尿量減少,腎機能検査値異常注),腎尿細管障害 |
| 血液 | 好酸球増多,白血球減少,血小板減少,貧血,白血球増多,顆粒球減少,好中球減少 |
| 生殖器 | 月経異常,勃起不全 |
| その他 | 浮腫,発熱,ほてり,味覚異常,耳鳴,難聴,胸痛,血清病,視覚障害(霧視,複視を含む),筋痛,関節痛,悪寒,異常感,無力症,腫脹,自傷,体重増加,高血糖,多汗症,顔面浮腫 |
| 臨床検査 | トリグリセライドの上昇,血清尿酸上昇,血清カリウムの上昇,血中アミラーゼ増加,総蛋白増加,総コレステロール増加,血中リン増加,血中コレステロール減少,血中ナトリウム減少,CRP増加,CK(CPK)増加 |
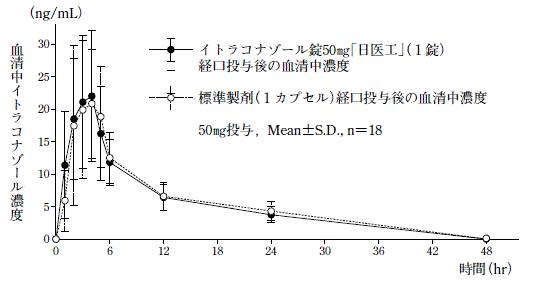
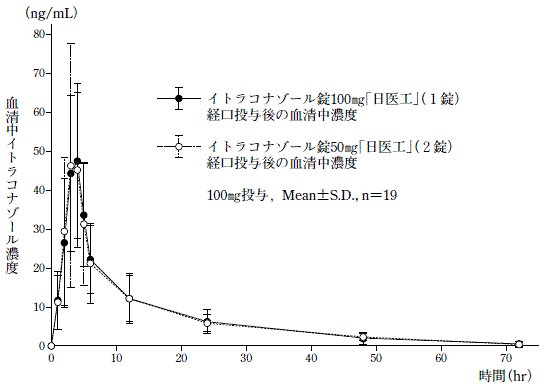
| 判定パラメータ AUC0→48 (ng・hr/mL) | 判定パラメータ Cmax (ng/mL) | 参考パラメータ Tmax (hr) | 参考パラメータ t1/2 (hr) | |
| イトラコナゾール錠50mg「日医工」 | 255.63±70.63 | 25.63±9.42 | 3.1±0.8 | 10.678±2.926 |
| 標準製剤 (カプセル50mg) | 263.48±67.80 | 26.27±9.80 | 3.5±1.2 | 10.991±3.457 |
| 判定パラメータ AUC0→72 (ng・hr/mL) | 判定パラメータ Cmax (ng/mL) | 参考パラメータ Tmax (hr) | 参考パラメータ t1/2 (hr) | |
| イトラコナゾール錠100mg「日医工」 | 516.81±218.74 | 53.55±20.86 | 3.4±0.8 | 15.08±6.04 |
| イトラコナゾール錠50mg「日医工」×2 | 509.84±199.98 | 53.40±29.07 | 3.5±0.6 | 16.61±5.86 |