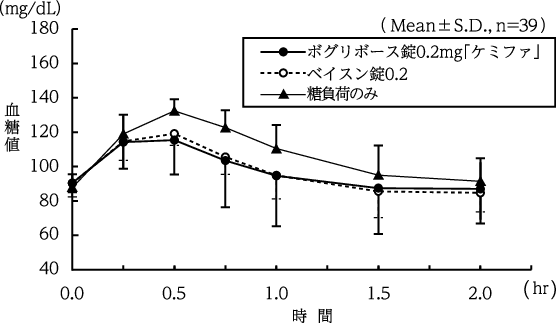
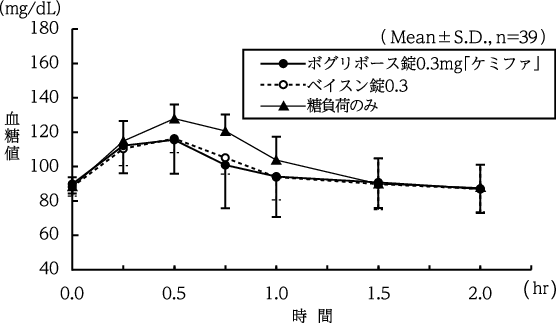
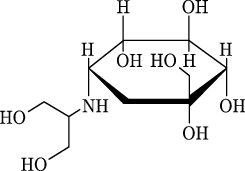
1
Morseth S.L. et al.:薬理と治療. 1991;19:4325-4340
2
Morseth S.L. et al.:薬理と治療. 1991;19:4375-4396
3
小高裕之 他:日本栄養・食糧学会誌. 1992;45:27-31
4
後藤由夫 他:臨床成人病. 1992;22:451-458
5
池田 衡 他:薬理と治療. 1991;19:4105-4117
6
Odaka H. et al.:J.Nutr.Sci.Vitaminol. 1992;38:27-37
7
池田 衡 他:薬理と治療. 1991;19:4451-4456
8
小高裕之 他:日本栄養・食糧学会誌. 1992;45:33-38
9
高見健治 他:薬理と治療. 1991;19:4457-4467
10
小高裕之 他:薬理と治療. 1991;19:4829-4834
11
日本薬品工業株式会社:生物学的同等性に関する資料(社内資料)