1
加藤隆一 他:臨床薬理. 1989;20(3):515-527
2
健康成人男子における第Ⅰ相臨床試験(多回投与試験)(ケアロードLA錠/ベラサスLA錠:2007年10月19日承認、申請資料概要2.7.6)
3
健康成人男子における第Ⅰ相臨床試験(単回投与試験)(ケアロードLA錠/ベラサスLA錠:2007年10月19日承認、申請資料概要2.7.6)
4
加藤隆一 他:臨床薬理. 1989;20(3):529-539
5
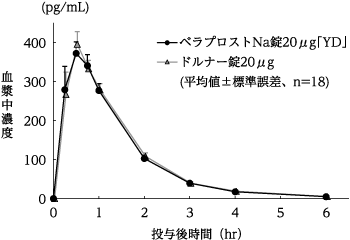
(株)陽進堂社内資料:生物学的同等性試験(錠20μg)
6
血清蛋白結合率(ドルナー錠/プロサイリン錠:1999年9月22日承認、申請資料概要へ.1.(9))
7
血漿中代謝物(ドルナー錠/プロサイリン錠:1999年9月22日承認、申請資料概要へ.1.(8).1))
8
Fukazawa, T. et al.:薬学雑誌. 2008;128(10):1459-1465
9
製造販売後臨床試験の概要(ドルナー錠/プロサイリン錠:2012年12月19日承認、再審査報告書)
10
(株)陽進堂社内資料:生物学的同等性試験(錠40μg)
11
国枝武義 他:臨牀と研究. 1997;74(10):2611-2629
12
Nishio, S. et al.:Japan. J. Pharmacol. 1988;47(1):1-10
13
西尾伸太郎 他:日本薬理学雑誌. 1989;94(6):351-361
14
Umetsu, T. et al.:Japan. J. Pharmacol. 1987;43(1):81-90
15
Umetsu, T. et al.:Arzneim. -Forsch. /Drug Res. 1989;39(1):68-73
16
Kajikawa, N. et al.:Arzneim. -Forsch. /Drug Res. 1989;39(4):495-499
17
勝村達喜 他:新薬と臨牀. 1989;38(9):1401-1406
18
池田康夫 他:現代医療. 1992;24(特):141-146
19
安納重康 他:血栓と循環. 2001;9(3):298-302
20
木村忠広 他:脈管学. 1992;32(4):327-331
21
勝村達喜 他:血管. 1989;12(4):195-199
22
Akiba, T. et al.:Br. J. Pharmacol. 1986;89(4):703-711
23
車谷元 他:血栓と循環. 1999;7(2):185-196
24
肺血管拡張作用(ドルナー錠/プロサイリン錠:1999年9月22日承認、申請資料概要ホ.2.(1))
25
Murai, T. et al.:Arzneim. -Forsch. /Drug Res. 1989;39(8):856-859
26
平野哲也 他:日本血栓止血学会誌. 1990;1(2):94-105
27
Nishio, S. et al.:Res. Comm. Chem. Pathol. Pharmacol. 1989;64(3):381-393
28
結城秀樹 他:血栓と循環. 2001;9(3):293-297








 0120-647-734
0120-647-734

