作成又は改訂年月
**
2023年7月改訂
(第7版)
*
2018年10月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
プラバスタチンナトリウム錠5mg「日医工」
販売名コード
承認・許可番号
22400AMX00913000
Pravastatin Sodium
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱等に表示の使用期限内に使用すること
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分の名称
プラバスタチンナトリウム
含量(1錠中)
5mg
添加物
乳糖,メタケイ酸アルミン酸マグネシウム,セルロース,ヒドロキシプロピルセルロース,ステアリン酸マグネシウム
性状
| 剤形・色調 | 白色の素錠 |
|---|
| 外形:表面 |  |
|---|
| 外形:裏面 |  |
|---|
| 外形:側面 |  |
|---|
| 質量 | 90mg |
|---|
| 直径 | 6.0mm |
|---|
| 厚さ | 2.5mm |
|---|
| 本体コード |  748 748 |
|---|
| 包装コード |  748 748 |
|---|
販売名
プラバスタチンナトリウム錠10mg「日医工」
販売名コード
承認・許可番号
22400AMX00914000
Pravastatin Sodium
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱等に表示の使用期限内に使用すること
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分の名称
プラバスタチンナトリウム
含量(1錠中)
10mg
添加物
乳糖,メタケイ酸アルミン酸マグネシウム,セルロース,ヒドロキシプロピルセルロース,ステアリン酸マグネシウム,三二酸化鉄
性状
| 剤形・色調 | 微紅色の割線のある素錠 |
|---|
| 外形:表面 |  |
|---|
| 外形:裏面 |  |
|---|
| 外形:側面 |  |
|---|
| 質量 | 140mg |
|---|
| 直径 | 7.0mm |
|---|
| 厚さ | 2.9mm |
|---|
| 本体コード |  749 749 |
|---|
| 包装コード |  749 749 |
|---|
禁忌
本剤の成分に対し過敏症の既往歴のある患者
妊婦又は妊娠している可能性のある婦人及び授乳婦(「妊婦,産婦,授乳婦等への投与」の項参照)
効能又は効果
用法及び用量
通常,成人にはプラバスタチンナトリウムとして,1日10mgを1回または2回に分け経口投与する。
なお,年齢・症状により適宜増減するが,重症の場合は1日20mgまで増量できる。
使用上の注意
慎重投与
重篤な肝障害又はその既往歴のある患者,アルコール中毒の患者[本剤は主に肝臓において代謝され,作用するので肝障害を悪化させるおそれがある。また,アルコール中毒の患者は,横紋筋融解症があらわれやすいとの報告がある。]
腎障害又はその既往歴のある患者[横紋筋融解症の報告例の多くが腎機能障害を有する患者であり,また,横紋筋融解症に伴って急激な腎機能の悪化が認められている。]
フィブラート系薬剤(ベザフィブラート等),免疫抑制剤(シクロスポリン等),ニコチン酸を投与中の患者[横紋筋融解症があらわれやすい。](「相互作用」の項参照)
甲状腺機能低下症の患者,遺伝性の筋疾患(筋ジストロフィー等)又はその家族歴のある患者,薬剤性の筋障害の既往歴のある患者[横紋筋融解症があらわれやすいとの報告がある。]
高齢者(「高齢者への投与」の項参照)
**重症筋無力症又はその既往歴のある患者[重症筋無力症(眼筋型,全身型)が悪化又は再発することがある。](「重大な副作用」の項参照)
重要な基本的注意
*腎機能に関する臨床検査値に異常が認められる患者に,本剤とフィブラート系薬剤を併用する場合には,治療上やむを得ないと判断される場合にのみ併用すること。急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。やむを得ず併用する場合には,定期的に腎機能検査等を実施し,自覚症状(筋肉痛,脱力感)の発現,CK(CPK)上昇,血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。
適用の前に十分な検査を実施し,高脂血症,家族性高コレステロール血症であることを確認した上で本剤の適用を考慮すること。本剤は高コレステロール血症が主な異常である高脂血症によく反応する。
あらかじめ高脂血症の基本である食事療法を行い,更に運動療法や高血圧・喫煙等の虚血性心疾患のリスクファクターの軽減等も十分考慮すること。
投与中は血中脂質値を定期的に検査し,治療に対する反応が認められない場合には投与を中止すること。
近位筋脱力,CK(CPK)高値,炎症を伴わない筋線維の壊死,抗HMG−CoA還元酵素(HMGCR)抗体陽性等を特徴とする免疫介在性壊死性ミオパチーがあらわれ,投与中止後も持続する例が報告されているので,患者の状態を十分に観察すること。なお,免疫抑制剤投与により改善がみられたとの報告例がある。(「重大な副作用」の項参照)
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
*フィブラート系薬剤
ベザフィブラート等 | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。[自覚症状(筋肉痛,脱力感)の発現,CK(CPK)上昇,血中及び尿中ミオグロビン上昇を認めた場合は直ちに投与を中止すること。] | 両剤とも単独投与により横紋筋融解症が報告されている。
危険因子:腎機能に関する臨床検査値に異常が認められる患者 |
免疫抑制剤
シクロスポリン等
ニコチン酸 | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。[自覚症状(筋肉痛,脱力感)の発現,CK(CPK)上昇,血中及び尿中ミオグロビン上昇を認めた場合は直ちに投与を中止すること。] | 危険因子:重篤な腎障害のある患者 |
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
横紋筋融解症(頻度不明)
筋肉痛,脱力感,CK(CPK)上昇,血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれ,これに伴って急性腎障害等の重篤な腎障害があらわれることがあるので,このような場合には直ちに投与を中止すること。
肝障害(頻度不明)
黄疸,著しいAST(GOT)・ALT(GPT)の上昇等を伴う肝障害があらわれることがあるので,観察を十分に行い,このような場合は投与を中止し適切な処置を行うこと。
血小板減少(頻度不明)
血小板減少があらわれることがあるので,このような場合には投与を中止し適切な処置を行うこと。[紫斑,皮下出血等を伴う重篤な症例も報告されている。]
間質性肺炎(頻度不明)
間質性肺炎があらわれることがあるので,長期投与であっても,発熱,咳嗽,呼吸困難,胸部X線異常等が認められた場合には投与を中止し,副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
ミオパチー(頻度不明)
ミオパチーがあらわれたとの報告がある。
免疫介在性壊死性ミオパチー(頻度不明)
免疫介在性壊死性ミオパチーがあらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
末梢神経障害(頻度不明)
末梢神経障害があらわれたとの報告がある。
過敏症状(頻度不明)
ループス様症候群,血管炎等の過敏症状があらわれたとの報告がある。
**重症筋無力症(頻度不明)
重症筋無力症(眼筋型,全身型)が発症又は悪化することがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
その他の副作用
| | 頻度不明 |
| 皮膚注1) | 発疹,湿疹,蕁麻疹,そう痒,紅斑,脱毛,光線過敏 |
| 消化器 | 嘔気・嘔吐,便秘,下痢,腹痛,胃不快感,口内炎,消化不良,腹部膨満感,食欲不振,舌炎 |
| 肝臓 | AST(GOT)上昇,ALT(GPT)上昇,Al-P上昇,LDH上昇,γ-GTP上昇,肝機能異常,ビリルビン上昇 |
| 腎臓 | BUN上昇,血清クレアチニン上昇 |
| 筋肉注2) | CK(CPK)上昇,筋肉痛,筋痙攣,筋脱力 |
| 精神神経系 | 頭痛,不眠,めまい |
| 血液注1) | 白血球減少,血小板減少,貧血 |
| その他 | 尿酸値上昇,尿潜血,倦怠感,浮腫,しびれ,顔面潮紅,耳鳴,関節痛,味覚異常 |
高齢者への投与
高齢者では,加齢による腎機能低下を考慮し,定期的に血液検査を行い,患者の状態を観察しながら,慎重に投与すること。[横紋筋融解症の報告例の多くが腎機能障害を有している。]
妊婦,産婦,授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には投与しないこと。[妊娠中の投与に関する安全性は確立していないが,他のHMG-CoA還元酵素阻害剤において,動物実験で出生児数の減少,生存・発育に対する影響及び胎児の生存率の低下と発育抑制が報告されている。また他のHMG-CoA還元酵素阻害剤において,ラットに大量投与した場合に胎児の骨格奇形,ヒトでは妊娠3ヵ月までの間に服用した場合に胎児の先天性奇形があらわれたとの報告がある。]
授乳中の婦人に投与することを避け,やむを得ず投与する場合には授乳を中止させること。[ラットで乳汁中への移行が報告されている。]
小児等への投与
低出生体重児,新生児,乳児,幼児又は小児に対する安全性は確立していない。
適用上の注意
服用時
メバロン酸の生合成は夜間に亢進することが報告されているので,適用にあたっては,1日1回投与の場合,夕食後投与とすることが望ましい。
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
SD系ラットにプラバスタチンナトリウムを投与した実験(10・30・100mg/kg/日混餌投与,24ヵ月間)において,100mg/kg/日投与群(最大臨床用量の250倍)の雄にのみ肝腫瘍の発生が対照群と比較して有意に認められているが,雌には認められていない。
イヌにプラバスタチンナトリウムを投与した実験(12.5・50・200mg/kg/日,5週,経口及び12.5・25・50・100mg/kg/日,13週,経口)において,100mg/kg/日投与群で脳の微小血管に漏出性出血等が認められている。
薬物動態
生物学的同等性試験
プラバスタチンナトリウム錠5mg「日医工」及び標準製剤を,クロスオーバー法によりそれぞれ2錠(プラバスタチンナトリウムとして10mg)健康成人男子に絶食単回経口投与して血漿中プラバスタチン濃度を測定し,得られた薬物動態パラメータ(AUC,Cmax)について90%信頼区間法にて統計解析を行った結果,いずれの場合もlog(0.8)〜log(1.25)の範囲内であり,両剤の生物学的同等性が確認された。
1)また,プラバスタチンナトリウム錠10mg「日医工」及び標準製剤をそれぞれ1錠(プラバスタチンナトリウムとして10mg)投与した場合においても,同様に両剤の生物学的同等性が確認された。
1)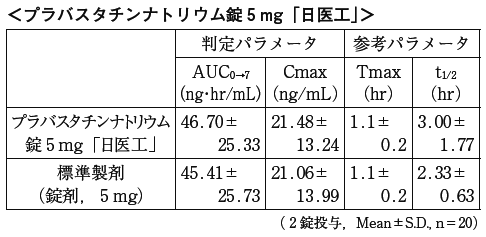
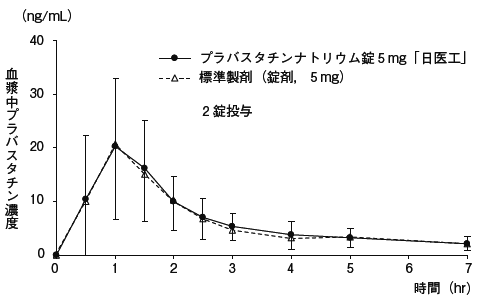
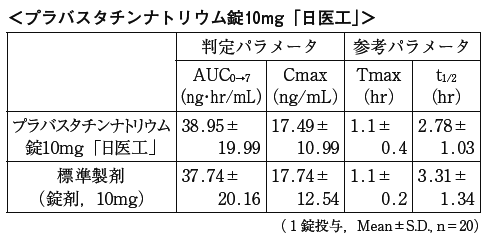
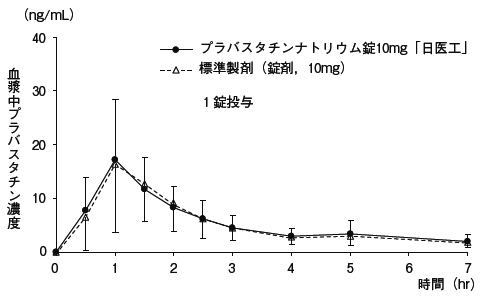
血漿中濃度並びにAUC,Cmax等のパラメータは,被験者の選択,体液の採取回数・時間等の試験条件によって異なる可能性がある。
溶出挙動
プラバスタチンナトリウム錠5mg「日医工」及びプラバスタチンナトリウム錠10mg「日医工」は,日本薬局方医薬品各条に定められたプラバスタチンナトリウム錠の溶出規格に適合していることが確認されている。2)
薬効薬理
コレステロール生合成の律速酵素であるHMG−CoA還元酵素を選択的に阻害することによってコレステロールの生合成を抑制する。3)
有効成分に関する理化学的知見
一般名
プラバスタチンナトリウム(Pravastatin Sodium)
化学名
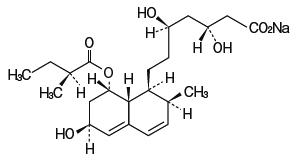
Monosodium(3R,5R)-3,5-dihydroxy-7-{(1S,2S,6S,8S,8aR)-6-hydroxy-2-methyl-8-[(2S)-2-methylbutanoyloxy]-1,2,6,7,8,8a-hexahydronaphthalen-1-yl} heptanoate
構造式
分子式
C23H35NaO7
分子量
446.51
性状
白色〜帯黄白色の粉末又は結晶性の粉末である。
水又はメタノールに溶けやすく,エタノール(99.5)にやや溶けやすい。
本品は吸湿性である。
本品1.0gを新たに煮沸して冷却した水20mLに溶かした液のpHは7.2〜8.2である。
取扱い上の注意
安定性試験
本品につき加速試験(40℃,相対湿度75%,6ヵ月)を行った結果,プラバスタチンナトリウム錠5mg「日医工」及びプラバスタチンナトリウム錠10mg「日医工」は通常の市場流通下において3年間安定であることが推測された。4)
包装
プラバスタチンナトリウム錠5mg「日医工」
100錠(10錠×10;PTP)
140錠[(14錠×2)×5袋;PTP〈パッケージ調剤用〉]
500錠(10錠×50;PTP)
700錠(14錠×50;PTP)
500錠(バラ)
プラバスタチンナトリウム錠10mg「日医工」
100錠(10錠×10;PTP)
140錠(14錠×10;PTP)
140錠[(14錠×2)×5袋;PTP〈パッケージ調剤用〉]
500錠(10錠×50;PTP)
700錠(14錠×50;PTP)
500錠(バラ)
主要文献及び文献請求先
主要文献
1
日医工株式会社 社内資料:生物学的同等性試験
2
日医工株式会社 社内資料:溶出試験
3
第十七改正日本薬局方解説書 C−4560,廣川書店,東京(2016)
4
日医工株式会社 社内資料:安定性試験
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
製造販売元
日医工株式会社
富山市総曲輪1丁目6番21



 748
748 748
748


 749
749 749
749