作成又は改訂年月
**
2018年10月改訂
(第18版)
*
2017年11月改訂
(第17版)
日本標準商品分類番号
日本標準商品分類番号等
2009年12月
1989年3月
薬効分類名
承認等
販売名
マグネスコープ静注38%シリンジ10mL
販売名コード
承認・許可番号
22300AMX00405
Magnescope
薬価基準収載年月
販売開始年月
貯法・使用期限等
規制区分
処方箋医薬品注)
注) 注意−医師等の処方箋により使用すること
組成
有効成分
ガドテル酸メグルミン
1シリンジ中の分量
3.7695g
性状
無色澄明の液で、わずかに粘性がある
粘度 (37℃)
約1.9mPa・s
浸透圧比
約4※(生理食塩液に対する比)
※本剤を4倍希釈して測定し、希釈倍数を乗じて求めた。
pH
6.9〜7.9
販売名
マグネスコープ静注38%シリンジ11mL
販売名コード
承認・許可番号
22600AMX00981
Magnescope
薬価基準収載年月
販売開始年月
貯法・使用期限等
規制区分
処方箋医薬品注)
注) 注意−医師等の処方箋により使用すること
組成
有効成分
ガドテル酸メグルミン
1シリンジ中の分量
4.1465g
性状
無色澄明の液で、わずかに粘性がある
粘度 (37℃)
約1.9mPa・s
浸透圧比
約4※(生理食塩液に対する比)
※本剤を4倍希釈して測定し、希釈倍数を乗じて求めた。
pH
6.9〜7.9
販売名
マグネスコープ静注38%シリンジ13mL
販売名コード
承認・許可番号
22600AMX00982
Magnescope
薬価基準収載年月
販売開始年月
貯法・使用期限等
規制区分
処方箋医薬品注)
注) 注意−医師等の処方箋により使用すること
組成
有効成分
ガドテル酸メグルミン
1シリンジ中の分量
4.9004g
性状
無色澄明の液で、わずかに粘性がある
粘度 (37℃)
約1.9mPa・s
浸透圧比
約4※(生理食塩液に対する比)
※本剤を4倍希釈して測定し、希釈倍数を乗じて求めた。
pH
6.9〜7.9
販売名
マグネスコープ静注38%シリンジ15mL
販売名コード
承認・許可番号
22300AMX00406
Magnescope
薬価基準収載年月
販売開始年月
貯法・使用期限等
規制区分
処方箋医薬品注)
注) 注意−医師等の処方箋により使用すること
組成
有効成分
ガドテル酸メグルミン
1シリンジ中の分量
5.6543g
性状
無色澄明の液で、わずかに粘性がある
粘度 (37℃)
約1.9mPa・s
浸透圧比
約4※(生理食塩液に対する比)
※本剤を4倍希釈して測定し、希釈倍数を乗じて求めた。
pH
6.9〜7.9
販売名
マグネスコープ静注38%シリンジ20mL
販売名コード
承認・許可番号
22300AMX00407
Magnescope
薬価基準収載年月
販売開始年月
貯法・使用期限等
規制区分
処方箋医薬品注)
注) 注意−医師等の処方箋により使用すること
組成
有効成分
ガドテル酸メグルミン
1シリンジ中の分量
7.5390g
性状
無色澄明の液で、わずかに粘性がある
粘度 (37℃)
約1.9mPa・s
浸透圧比
約4※(生理食塩液に対する比)
※本剤を4倍希釈して測定し、希釈倍数を乗じて求めた。
pH
6.9〜7.9
一般的名称
警告
本剤を髄腔内に投与すると重篤な副作用を発現するおそれがあるので、髄腔内には投与しないこと。
重篤な腎障害のある患者では、ガドリニウム造影剤による腎性全身性線維症の発現のリスクが上昇することが報告されているので、腎障害のある患者又は腎機能が低下しているおそれのある患者では、十分留意すること。(「慎重投与」6.、「重要な基本的注意」3.、4.の項参照)
禁忌
本剤の成分又はガドリニウム造影剤に対し過敏症の既往歴のある患者
原則禁忌
一般状態の極度に悪い患者
気管支喘息のある患者
[類薬でショック、アナフィラキシーが報告されている]
重篤な肝障害のある患者
[肝機能に影響を及ぼすおそれがある]
重篤な腎障害のある患者
[本剤の主たる排泄臓器は腎臓であり、腎機能低下患者では排泄遅延から急性腎不全等の症状が悪化するおそれがある]
効能又は効果
効能又は効果に関連する使用上の注意
*ガドリニウム造影剤を複数回投与した患者において、非造影T1強調MR画像上、小脳歯状核、淡蒼球等に高信号が認められたとの報告や脳の剖検組織からガドリニウムが検出されたとの報告があるので、ガドリニウム造影剤を用いた検査の必要性を慎重に判断すること。
磁気共鳴コンピューター断層撮影における下記造影
脳・脊髄造影
躯幹部・四肢造影
用法及び用量
通常、成人には本剤0.2mL/kgを静脈内注射する。腎臓を対象とする場合は、0.1mL/kgを静脈内注射するが、必要に応じて、0.2mL/kgまで増量することができる。
使用上の注意
慎重投与
アレルギー性鼻炎、発疹、蕁麻疹等を起こしやすいアレルギー体質を有する患者
両親、兄弟に気管支喘息、アレルギー性鼻炎、発疹、蕁麻疹等を起こしやすいアレルギー体質を有する患者
薬物過敏症の既往歴のある患者
既往歴を含めて、痙攣、てんかん及びその素質のある患者
[類薬で痙攣が報告されている]
高齢者
[「高齢者への投与」の項参照]
腎障害のある患者又は腎機能が低下しているおそれのある患者
[腎機能が悪化するおそれがある (「原則禁忌」4.の項参照)]
重要な基本的注意
過敏反応に備え、使用に際しては十分な問診を行うこと。
ショック、アナフィラキシー等が発現することがあるので、本剤の投与に際しては必ず救急処置の準備を行うこと。また、類薬において投与開始より1時間〜数日後にも遅発性副作用 (発熱、発疹、悪心、血圧低下、呼吸困難等) があらわれるとの報告があるので、投与後も患者の状態を十分に観察すること。患者に対して、上記の症状があらわれた場合には速やかに主治医等に連絡するよう指導するなど適切な対応をとること。
腎障害のある患者又は腎機能が低下しているおそれのある患者に本剤を投与する場合には、患者の腎機能を十分に評価した上で慎重に投与すること。
長期透析が行われている終末期腎障害、eGFR (estimated glomerular filtration rate:推算糸球体ろ過値) が30mL/min/1.73m2未満の慢性腎障害、急性腎不全の患者では、ガドリニウム造影剤による腎性全身性線維症の発現のリスクが上昇することが報告されているので、本剤の投与を避け、他の検査法で代替することが望ましい。
副作用
副作用等発現状況の概要
承認時
本剤が投与された829例中11例 (1.3%) に副作用が報告された。その症状は発疹3件 (0.4%)、悪心3件 (0.4%)、頭痛3件 (0.4%)、熱感2件 (0.2%)、味覚異常2件 (0.2%)、そう痒症1件 (0.1%)、嘔吐1件 (0.1%)、胸部不快感1件 (0.1%)、眼の異物感1件 (0.1%) であった。
再審査終了時
市販後の使用成績調査における安全性解析対象症例3,444例中、副作用発現症例は32例 (0.9%) であり、その主な副作用は、悪心14件 (0.4%)、嘔吐3件 (0.1%) 等であった。また、小児 (15歳未満) については安全性解析対象症例41例中 (乳児1例、幼児4例、小児36例)、副作用の発現症例はなかった。
重大な副作用
ショック、アナフィラキシー
ショック、アナフィラキシーが発現し、血圧低下、意識消失、呼吸困難、喉頭浮腫、顔面浮腫、全身の潮紅、蕁麻疹等があらわれることがあるので、投与後も観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
腎性全身性線維症 (Nephrogenic Systemic Fibrosis、NSF)
外国において、重篤な腎障害のある患者への本剤使用後に、腎性全身性線維症を発現した症例が報告されているので、投与後も観察を十分に行い、皮膚のそう痒、腫脹、硬化、関節の硬直、筋力低下等の異常の発生には十分留意すること。
その他の副作用
過敏症
0.1%未満
発疹、そう痒症、蕁麻疹
過敏症
頻度不明
顔面浮腫、血管浮腫、潮紅、紅斑、眼瞼浮腫
循環器
0.1%未満
血圧低下
循環器
頻度不明
血圧上昇
呼吸器
0.1%未満
咳嗽、くしゃみ
呼吸器
頻度不明
呼吸困難、口腔咽頭不快感、鼻閉
消化器
0.1%〜0.5%未満
悪心
消化器
0.1%未満
嘔吐
精神神経系
0.1%未満
頭痛
精神神経系
頻度不明
浮動性めまい
眼
0.1%未満
眼の異物感
眼
頻度不明
眼充血、眼そう痒症
その他
0.1%未満
熱感、味覚異常、胸部不快感、眼の異物感、異常感
その他
頻度不明
感覚鈍麻、冷感、多汗症
上記のような症状があらわれることがあるので、このような場合には、必要に応じ適切な処置を行うこと。
高齢者への投与
本剤は主として腎臓から排泄されるが、高齢者では腎機能が低下していることが多いため高い血中濃度を維持するおそれがあるので、患者の状態を十分に観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、診断上の有益性が危険性を上回ると判断される場合にのみ投与すること。
[妊娠中及び授乳中の投与に関する安全性は確立していない]
投与後48時間は授乳を避けさせること。
[動物試験 (ヤギ静脈内投与) で乳汁中に移行することが報告されている]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない (使用経験が少ない)。
臨床検査結果に及ぼす影響
適用上の注意
投与経路
髄腔内投与は行わないこと。
投与時
通常、コントラストは本剤投与直後から約45分後まで持続する。追加投与によって有効性が向上するとは限らないので追加投与しないこと。
注射に際しては血管外に漏出しないよう十分注意する。血管外に漏出した場合には、注射部疼痛や腫脹があらわれることがある。
開封後
1回の検査にのみ使用し、余剰の溶液は廃棄すること。
薬物動態
健康成人男子に本剤0.1mL/kg (0.05mmol/kg)、0.2mL/kg (0.10mmol/kg) を静脈内投与したところ、血中からの分布相半減期及び消失相半減期はそれぞれ5.0〜5.9分、72.0〜72.6分で、6時間後までに投与量の89%以上が、24時間後までに95%以上が尿中に排泄された。また、本剤は代謝されることなく、未変化体のまま排泄されることが確認された。1)
臨床成績
比較試験を含む第II相及び第III相臨床試験における承認用量での有効率 (「有効」以上) は90.2% (553/613) であり、各部位別の有効率は次のとおりであった。
(表1参照)
〔比較臨床試験成績〕2)
ガドペンテト酸ジメグルミンを対照とし、脳・脊髄疾患及び躯幹部・四肢疾患 (心臓・胸部疾患、腹部・四肢疾患) を対象とした比較臨床試験 (投与量:腎臓以外を撮像対象とする場合は0.2mL/kgで、腎臓を撮像対象とする場合は0.1mL/kg) を実施し、本剤投与群の有効率 (「有効」以上の割合) は92.5% (135/146)、対照薬群の有効率は95.2% (140/147) となり、本剤は対照薬群との間に有意差が認められなかったこと (Mann-Whitney検定p=0.547) から、臨床的に同等とみなせる差 (Δ) を10%として同等性の検証を行ったところ、両薬剤群間の有効率の差は-2.8%で、その90%信頼区間は「-7.4%〜1.8%」となり同等性が検証された。成績及び同等性検証結果は次のとおりであった。
(表2参照)
臨床成績の表
| 脳・脊髄 | 94.2% (210/223) |
| 心臓 | 88.2% (45/51) |
| 胸部 | 78.6% (22/28) |
| 肝臓 | 91.2% (104/114) |
| 腎臓 | 96.4% (80/83) |
| 骨盤部 | 77.8% (63/81) |
| 骨・軟部組織 | 95.5% (21/22) |
| その他 | 72.7% (8/11) |
表2
造影効果
総合的有効性:T1強調画像、Dynamic撮影における診断能の向上性の総合評価
(T1強調画像を必須とし、可能な場合はDynamic撮影も実施)
〔読影委員会評価〕
| | 領域 | 投与群 | 計 | 著効 | 有効 | やや有効 | 無効 | 判定不能 | Mann-
Whitney
検定 | 有効率※1
(%)
(補正値)※2 |
| 全解析対象 | 脳・脊髄 | ガドテル酸メグルミン群 | 38 | 16 | 18 | 4 | 0 | 0 | N.S.
p=0.478 | 89.5 |
| 全解析対象 | 脳・脊髄 | ガドペンテト酸ジメグルミン群 | 38 | 19 | 16 | 3 | 0 | 0 | N.S.
p=0.478 | 92.1 |
| 全解析対象 | 心臓・胸部 | ガドテル酸メグルミン群 | 32 | 10 | 17 | 4 | 1 | 0 | N.S.
p=0.906 | 84.4 |
| 全解析対象 | 心臓・胸部 | ガドペンテト酸ジメグルミン群 | 34 | 8 | 23 | 3 | 0 | 0 | N.S.
p=0.906 | 91.2 |
| 全解析対象 | 腹部・四肢 | ガドテル酸メグルミン群 | 76 | 47 | 27 | 2 | 0 | 0 | N.S.
p=0.511 | 97.4 |
| 全解析対象 | 腹部・四肢 | ガドペンテト酸ジメグルミン群 | 75 | 50 | 24 | 1 | 0 | 0 | N.S.
p=0.511 | 98.7 |
| 全解析対象 | 合計 | ガドテル酸メグルミン群 | 146 | 73 | 62 | 10 | 1 | 0 | N.S.
p=0.547 | 92.5 (92.4) |
| 全解析対象 | 合計 | ガドペンテト酸ジメグルミン群 | 147 | 77 | 63 | 7 | 0 | 0 | N.S.
p=0.547 | 95.2 (95.3) |
| ※3 | 合計 | ガドテル酸メグルミン群 | 135 | 68 | 58 | 8 | 1 | 0 | N.S.
p=0.458 | 93.3 (93.3) |
| ※3 | 合計 | ガドペンテト酸ジメグルミン群 | 132 | 71 | 56 | 5 | 0 | 0 | N.S.
p=0.458 | 96.2 (96.2) |
| ※4 | 合計 | ガドテル酸メグルミン群 | 130 | 62 | 57 | 10 | 1 | 0 | N.S.
p=0.592 | 91.5 (91.5) |
| ※4 | 合計 | ガドペンテト酸ジメグルミン群 | 131 | 65 | 59 | 7 | 0 | 0 | N.S.
p=0.592 | 94.7 (94.7) |
| ※5 | 合計 | ガドテル酸メグルミン群 | 122 | 58 | 55 | 8 | 1 | 0 | N.S.
p=0.480 | 92.6 (92.6) |
| ※5 | 合計 | ガドペンテト酸ジメグルミン群 | 116 | 59 | 52 | 5 | 0 | 0 | N.S.
p=0.480 | 95.7 (95.8) |
薬効薬理
本剤はその構造にキレート化したGdイオンを有しており常磁性を示す。MRI検査において本剤を投与すると、Gdイオンの強い磁気モーメントにより組織中の水プロトンの緩和時間が短縮し、MR画像上で組織及び病変部のコントラスト増強効果が得られる。
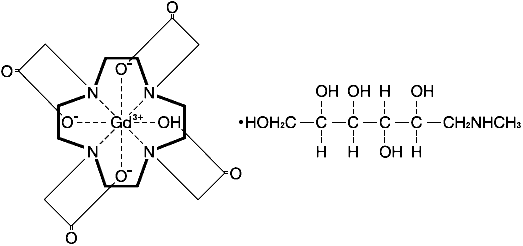
有効成分に関する理化学的知見
一般名
ガドテル酸メグルミン (meglumine gadoterate)
化学名
(−)-1-deoxy-1-(methylamino)-D-glucitol hydrogen [1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetato (4-)] gadolinate (1-) (1:1)
構造式
分子式
C16H25GdN4O8・C7H17NO5
分子量
753.86
包装
マグネスコープ静注38%シリンジ10mL:5本
マグネスコープ静注38%シリンジ11mL:5本
マグネスコープ静注38%シリンジ13mL:5本
マグネスコープ静注38%シリンジ15mL:5本
マグネスコープ静注38%シリンジ20mL:5本
主要文献及び文献請求先
主要文献
1
松山真記子ほか:診療と新薬. 1994; 31 (3):513-521.
2
谷本 伸弘ほか:診療と新薬. 1996; 33 (9):1367-1389.
**文献請求先・お問い合わせ先
ゲルベ・ジャパン株式会社
〒102-0083 東京都千代田区麹町6丁目4番6号
フリーダイヤル 0120-693-180
製造販売業者等の氏名又は名称及び住所
**製造販売元
ゲルベ・ジャパン株式会社
東京都千代田区麹町6丁目4番6号
その他の説明(付属機器の取り扱い等)
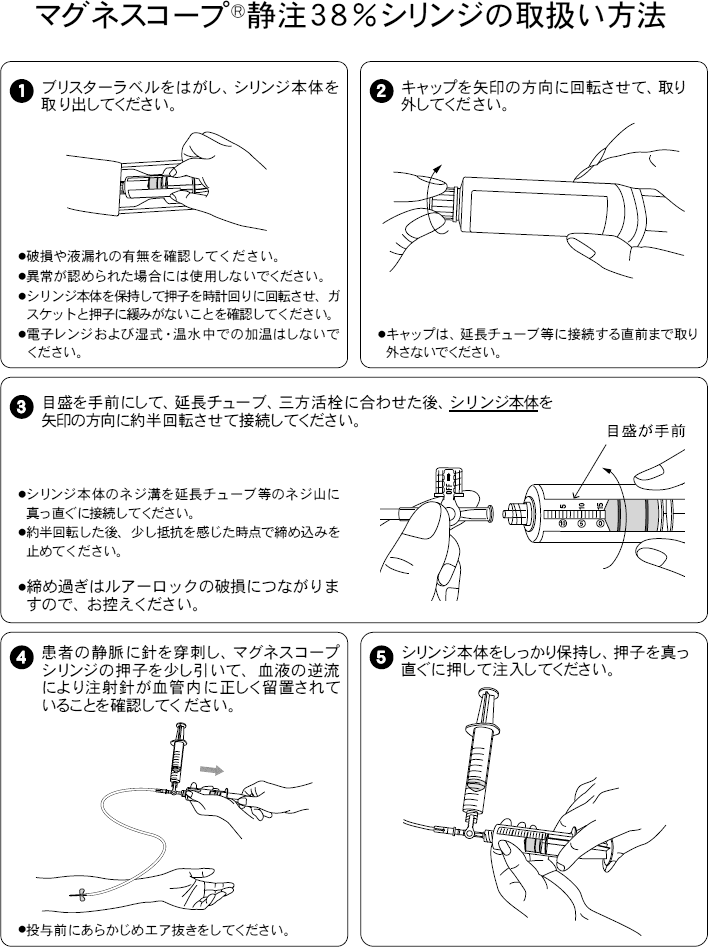 材質
材質