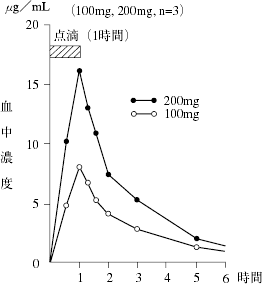
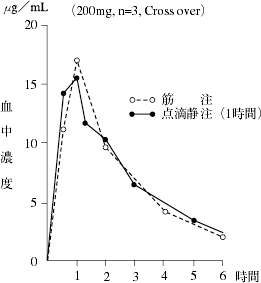
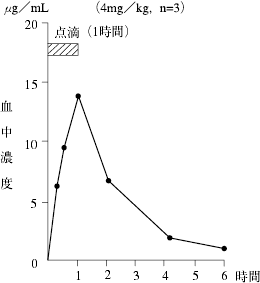
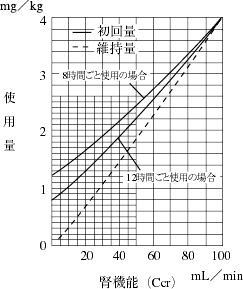
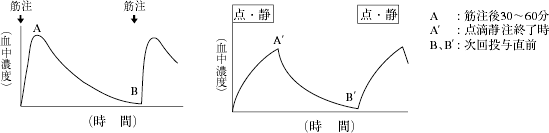
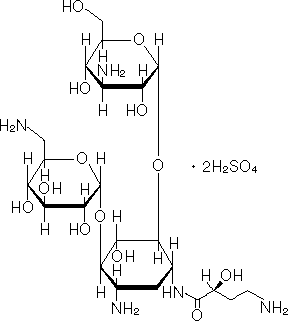
アミノグリコシド系抗生物質製剤
1管 347円
| 剤形 | アンプル |
|---|---|
| pH | 6.0〜7.5 |
| 浸透圧比 | 約1〔100mg(力価)/mL(注射用水)〕 |
| 性状 | 無色〜微黄色澄明の液 |
| 剤形 | アンプル |
|---|---|
| pH | 6.0〜7.5 |
| 浸透圧比 | 約1〔100mg(力価)/mL(注射用水)〕 |
| 性状 | 無色〜微黄色澄明の液 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 腎障害を起こすおそれのある血液代用剤: デキストラン ヒドロキシエチルデンプン 等 | 腎障害が発現、悪化することがあるので、併用は避けることが望ましい。 腎障害が発生した場合には、投与を中止し、透析療法等適切な処置を行うこと。 | 機序は明確でないが、併用によりアミノグリコシド系抗生物質の血中への蓄積、近位尿細管上皮の空胞変性が生じるという報告がある。 |
| ループ利尿剤: エタクリン酸 フロセミド アゾセミド 等 | 腎障害及び聴器障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 | 機序は明確でないが、併用によりアミノグリコシド系抗生物質の血中濃度の上昇、腎への蓄積が起こるという報告がある。 |
| 腎毒性及び聴器毒性を有する薬剤: バンコマイシン エンビオマイシン 白金含有抗悪性腫瘍剤 (シスプラチン、カルボプラチン、ネダプラチン) 等 | 腎障害及び聴器障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 | 両薬剤ともに腎毒性、聴器毒性を有するが、相互作用の機序は不明。 |
| 麻酔剤 筋弛緩剤: ツボクラリン パンクロニウム臭化物 ベクロニウム臭化物 トルペリゾン A型ボツリヌス毒素製剤 等 | 呼吸抑制があらわれるおそれがある。呼吸抑制があらわれた場合には必要に応じ、コリンエステラーゼ阻害剤、カルシウム製剤の投与等の適切な処置を行うこと。 | 両薬剤ともに神経筋遮断作用を有しており、併用によりその作用が増強される。 |
| 腎毒性を有する薬剤: シクロスポリン アムホテリシンB 等 | 腎障害が発現、悪化するおそれがある。 | 両薬剤ともに腎毒性を有するが、相互作用の機序は不明。 |