1
長浜萬蔵ほか: 先天異常. 1966; 6: 20-32
2
Stuart MJ, et al.: N Engl J Med. 1982; 307: 909-912
3
門間和夫: 小児科の進歩. 1983; 2: 95-102
4
Buck ML, et al.: Ann Pharmacother. 1991; 25: 244-247
5
AHFS Drug Information 2000(McEvoy GK, et al., ed.). Bethesda, Md: Am Soc Health Syst Pharm; 2000. p1946-1947
6
AHFS Drug Information 2000(McEvoy GK, et al., ed.). Bethesda, Md: Am Soc Health Syst Pharm; 2000. p1937-1945
7
社内資料: 生物学的同等性試験に関する資料
8
東純一ほか: 月刊薬事. 1998; 40: 3005-3016
9
Bloomer JC, et al.: Xenobiotica. 1995; 25: 917-927
10
長崎信行ほか: 現代の薬理学(田中潔編). 東京. 金原出版; 1968: p104-109
11
Taylor G, et al.: Br J Clin Pharmacol. 1983; 15: 287-293
12
Nakamura K, et al.: Pharmacogenetics. 1996; 6: 449-457
13
加地正郎ほか: 臨牀と研究. 1977; 54: 205-213
14
早川謙一ほか: 新薬と臨床. 1992; 41: 1426-1431
15
土井邦紘ほか: 医学と薬学. 1992; 27: 1535-1540
16
髙折修二ほか監訳: グッドマン・ギルマン薬理書(上)第12版. 廣川書店; 2013: p841
17
Martindale: The Complete Drug Reference. 33rd ed.(Parfitt K, et al., ed.). London: Pharmaceutical Press; 2002. p423-424
18
Lippert TH, et al.: Arzneim-Forsch. 1965; 15: 1079-1080








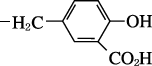
 0120-189-228
0120-189-228

