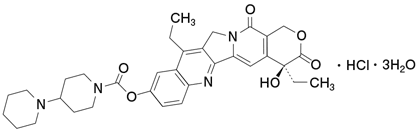
1
Ando Y,et al.:Cancer Res. 2000;60:6921-6926
2
Innocenti F,et al.:J Clin Oncol. 2004;22:1382-1388
3
Minami H,et al.:Pharmacogenet Genomics. 2007;17:497-504
4
Zatloukal P,et al.:Ann Oncol. 2010;21:1810-1816
5
田口鐵男ほか:癌と化学療法. 1990;17:115-120
6
伯水英夫ほか:薬物動態. 1991;6:73-95
7
伯水英夫ほか:薬物動態. 1991;6:105-125
8
河野彬ほか:癌と化学療法. 1991;18:2175-2178
9
川戸康義ほか:薬物動態. 1991;6:899-907
10
Dodds HM,et al.:J Pharmacol Exp Ther. 1998;286:578-583
11
Haaz M-C,et al.:Cancer Res. 1998;58:468-472
12
Rivory LP,et al.:Cancer Chem Pharm. 1995;36:176-179
13
Haaz M-C,et al.:Pharmacol Toxicol. 1997;80:91-96
14
田中義輝ほか:YAKUGAKU ZASSHI. 2013;133:463-471
15
Saito Y,et al.:Curr Pharmacogenomics. 2007;5:49-78
16
Kaneda N,et al.:Cancer Res. 1990;50:1721-1725
17
Atsumi R,et al.:Xenobiotica. 1991;21:1159-1169
18
根来俊一ほか:癌と化学療法. 1991;18:1013-1019
19
竹内正七ほか:癌と化学療法. 1991;18:1681-1689
20
二ッ木浩一ほか:癌と化学療法. 1994;21:1033-1038
21
Shimada Y,et al.:J Clin Oncol. 1993;11:909-913
22
田口鐵男ほか:癌と化学療法. 1994;21:1017-1024
23
池田重雄ほか:Skin Cancer. 1993;8:503-513
24
太田和雄ほか:癌と化学療法. 1994;21:1047-1055
25
Conroy T,et al.:N Engl J Med. 2011;364:1817-1825
26
Okusaka T,et al.:Cancer Sci. 2014;105:1321-1326
27
Sawada S,et al:Chem Pharm Bull. 1991;39:1446-1454
28
第十八改正 日本薬局方解説書. 廣川書店. 2021:C-691-698
29
Kawato Y,et al.:Cancer Res. 1991;51:4187-4191
30
今井輝子:日薬理誌. 2009;134:281-284
31
新田和男ほか:癌と化学療法. 1987;14:850-857
32
古田富雄ほか:癌と化学療法. 1988;15:2757-2760
33
Kawato Y,et al.:Cancer Chem Pharm. 1991;28:192-198